题目内容
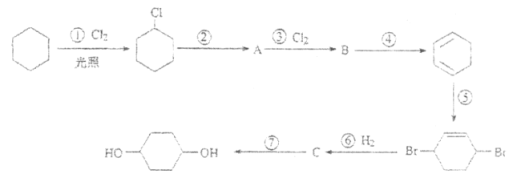
【题目】在密闭容器中,投入1 mol N2和3 mol H2分别在以下不同实验条件下进行反应。下列分析正确的是
容器编号 | 实验条件 | 平衡时反应中的能量变化 |
I | 恒温恒容 | 放热Q1kJ |
II | 恒温恒压 | 放热Q2kJ |
A.放出热量:Q1<Q2B.N2的转化率:II>I
C.平衡常数:II>ID.平衡时氨气的体积分数:I>II
【答案】AB
【解析】
N2和H2合成氨气的反应方程式为:N2+3H2![]() 2NH3,容器I的反应和容器II的反应主要是压强改变导致两个反应的平衡状态不一致,刚开始两个反应压强一致,随着反应进行,反应I压强减小,反应II压强不变,因此反应I到反应II压强增大,平衡向正反应方向移动。
2NH3,容器I的反应和容器II的反应主要是压强改变导致两个反应的平衡状态不一致,刚开始两个反应压强一致,随着反应进行,反应I压强减小,反应II压强不变,因此反应I到反应II压强增大,平衡向正反应方向移动。
A. 反应I到反应II平衡向正反应方向移动,所以达到平衡时反应放出的热量Q2>Q1,A正确;
B. 反应I到反应II压强增大,平衡向正反应方向移动,N2的转化率增大,B正确;
C. 化学平衡常数只与温度有关,与其它条件无关。由于I、II温度相同,所以平衡常数相等,C错误;
D.反应II相对于I来说就是增大压强。增大压强,化学平衡正向移动,因此达到平衡时氨气的体积分数:I<II,D错误;
答案选AB。

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目