题目内容
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、SO42—)中回收氧化铁流程如图所示:

已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生反应的离子方程式:_____,指出使用空气的优点是:_______。
(2)已知Fe3+(aq)+3OH-(aq)===Fe(OH)3(s) ΔH=-Q1 kJ/mol,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=______。
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上下列微粒在该溶液中可存在的最大浓度c(Fe3+)=_________。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是_____(填化学式,下同),用____试剂可将其除去。
【答案】4Fe2++O2+4H+===4Fe3++2H2O 耗费少且无污染 -(Q2+Q1) kJ/mol 3.5×10-11 mol/L Al(OH)3 NaOH
【解析】
(1)酸性废液中通入空气时,Fe2+被空气中的氧气所氧化,离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,根据空气的来源和对环境的影响分析解答;
(2)根据盖斯定律分析计算;
(3)溶液pH=5,则c(OH-)=10-9molL-1,根据Ksp[Fe(OH)3]=3.5×10-38计算;
(4)根据Ksp[Al(OH)3]=1.0×10-33和Ksp[Mg(OH)2]=1.2×10-11,计算判断铝离子、镁离子是否完全沉淀,结合Al(OH)3溶于强碱,而Fe(OH)3不溶分析解答。
(1)酸性废液中通入空气时,Fe2+被空气中的氧气所氧化,离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,该方法的优点是耗费少且无污染,故答案为:4Fe2++O2+4H+═4Fe3++2H2O,耗费少且无污染;
(2)根据盖斯定律由Fe3+(aq)+3OH-(aq)=Fe(OH)3(s) △H=-Q1kJ/mol,题(1)中每生成1mol含铁微粒时,放热Q2,则1 mol Fe2+全部Fe3+放热为Q2,Fe3+转化为Fe(OH)3(s)的放热为Q1,所以1 mol Fe2+全部转化为Fe(OH)3(s)的热效应△H=-(Q2+Q1)kJmol-1,故答案为:-(Q2+Q1)kJmol-1;
(3)溶液pH=5,则c(OH-)=10-9molL-1,根据Ksp[Fe(OH)3]=3.5×10-38,则c(Fe3+)=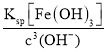 =3.5×10-11molL-1,故答案为:3.5×10-11molL-1;
=3.5×10-11molL-1,故答案为:3.5×10-11molL-1;
(4)根据Ksp[Al(OH)3]=1.0×10-33,可计算出溶液pH=5时,c(OH-)=10-9molL-1,c(Al3+)=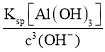 =1.0×10-6<1.0×10-5,Al3+也几乎完全沉淀,Mg2+没有沉淀故可能混有的杂质是Al(OH)3;Al(OH)3溶于强碱,而Fe(OH)3不溶,故可用NaOH溶液除去,故答案为:Al(OH)3;NaOH溶液。
=1.0×10-6<1.0×10-5,Al3+也几乎完全沉淀,Mg2+没有沉淀故可能混有的杂质是Al(OH)3;Al(OH)3溶于强碱,而Fe(OH)3不溶,故可用NaOH溶液除去,故答案为:Al(OH)3;NaOH溶液。

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案