题目内容
16.Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.(1)与N3-含有相同电子数的三原子分子的空间构型是V形.
(2)Cu具有良好的导电、导热和延展性,请解释Cu具有导电性的原因.
(3)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是sp3、sp2,乙醛分子中H-C-O的键角大于乙醇分子中的H-C-O的键角(填“大于”、“等于”或“小于”).
(4)Cu+的核外电子排布式为1s22s22p63s23p63d10,其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu,但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成Cu2OCu+的3d轨道上电子全满其结构稳定
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[Cu(H2O)2(Cl)2]具有极性的分子的结构式
 .
.(6))Cu3N的晶胞结构下图所示:
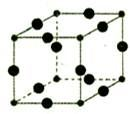
N3-的配位数为6,Cu+半径为apm,N3-半径为b pm,Cu3N的密度$\frac{103×10{\;}^{30}}{4(a+b){\;}^{3}N{\;}_{A}}$g/cm3.(阿伏加德罗为常数用NA表示).
分析 (1)与N3-含有相同电子数的微粒为等电子体,如NO2-,等电子体结构相似,根据价层电子对互斥理论确定其空间构型;
(2)含有自由电子的金属单质能导电;
(3)乙醛分子中甲基上碳原子含有4个σ键,醛基上的碳原子含有3个σ键,据此判断碳原子的杂化方式,碳原子杂化方式不同导致其键角不同;
(4)Cu+的核外有28个电子,根据构造原理书写其基态离子核外电子排布式,原子轨道处于全空、半满或全满时最稳定;
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,[Cu(H2O)2(Cl)2]具有极性的分子,说明该分子的结构不对称;
(6)Cu3N的晶胞结构如图,大球个数=12×$\frac{1}{4}$=3,小球个数=$\frac{1}{8}$=1,所以大球表示Cu原子、小球表示N原子,N3-的配位数=3×2=6,Cu3N的密度=$\frac{m}{V}$.
解答 解:(1)与N3-含有相同电子数的微粒为等电子体,如NO2-,得电子体结构相似,亚硝酸根离子中N原子价层电子对个数=2+$\frac{1}{2}$×(5+1-2×2)=3且含有一个孤电子对,所以为V形结构,
故答案为:V形;
(2)铜属于金属晶体,晶体中含有可以自由移动的电子,通电后定向移动,所以能导电,
故答案为:Cu为金属晶体,晶体中存在可自由移动的电子,通电后定向移动;
(3)乙醛分子中甲基上碳原子含有4个σ键,醛基上的碳原子含有3个σ键,所以甲基中的碳原子采用sp3杂化,醛基中的碳原子采用sp2杂化,醛基中碳原子采用sp2杂化、乙醇中含有醇羟基的碳原子采用sp3杂化,导致乙醛分子中H-C-O的键角大于乙醇分子中的H-C-O的键角,
故答案为:sp3、sp2;大于;
(4)Cu+的核外有28个电子,根据构造原理知其基态离子核外电子排布式1s22s22p63s23p63d10,原子轨道处于全空、半满或全满时最稳定,Cu+的3d轨道上全满,稳定,
故答案为:1s22s22p63s23p63d10;Cu+的3d轨道上电子全满其结构稳定;
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,[Cu(H2O)2(Cl)2]具有极性的分子,说明该分子的结构不对称,则其结构式为 ,
,
故答案为: ;
;
(6)Cu3N的晶胞结构如图,大球个数=12×$\frac{1}{4}$=3,小球个数=$\frac{1}{8}$=1,所以大球表示Cu原子、小球表示N原子,N3-的配位数=3×2=6,晶胞的体积=[(2a+2b)×10-10cm]3,Cu3N的密度=$\frac{m}{V}$=$\frac{\frac{64×3+14}{N{\;}_{A}}}{[(2a+2b)×10{\;}^{-10}]{\;}^{3}}$g/cm3=$\frac{103×10{\;}^{30}}{4(a+b){\;}^{3}N{\;}_{A}}$g/cm3,
故答案为:6;$\frac{103×10{\;}^{30}}{4(a+b){\;}^{3}N{\;}_{A}}$.
点评 本题考查了物质结构和性质,涉及晶胞的计算、原子杂化、核外电子排布等知识点,根据密度公式、价层电子对互斥理论、构造原理等知识点来分析解答,这些知识点都是考试热点,难点是晶胞的计算,明确各个字母的含义,注意(1)中采用知识迁移的方法进行解答,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| A. | 达到平衡时,容器I中的CH3OH体积分数与容器Ⅱ相等 | |
| B. | 容器I中反应的平衡常数K=0.08 | |
| C. | 若起始时向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向逆反应方向进行 | |
| D. | 容器I中反应达到平衡所需时间比容器Ⅲ中的长 |
| A. | Cl2、Br2、Fe3+ | B. | Br2、Cl2、Fe3+ | C. | Fe3+、Cl2、Br2 | D. | Cl2、Fe3+、Br2 |
| A. | 某有机化合物完全燃烧生成等物质的量的CO2和H2O,则该有机物的分子式一定CnH2n | |
| B. | 烷烃 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 | |
| C. | 如图所示的有机物分子式为C14H12O2,能发生银镜反应 | |
| D. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH |
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷可自燃而氮气需在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 将CO2通入Na2SiO3溶液中,有白色沉淀生成 | 酸性:H2CO3>H2SiO3 |
| ⑥ | 向溶液中滴加盐酸酸化的BaCl2溶液出现白色沉淀 | 该溶液中一定有SO42- |
| A. | ①②⑥ | B. | ①④⑤ | C. | ②③⑤ | D. | ④⑤⑥ |
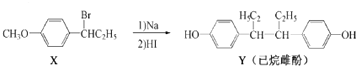
下列叙述不正确的是( )
| A. | 用FeCl3溶液可以鉴别化合物X和Y | |
| B. | Y的苯环上的二氯取代物有8种同分异构体 | |
| C. | 在NaOH水溶液中加热,化合物X发生消去反应 | |
| D. | X转化为Y的反应类型为取代反应 |
| A. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氧化镁与稀盐酸混合:O2-+2H+═2Cl--+H2O | |
| C. | 碳酸钙与稀盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 盐酸与澄清石灰水反应:H++OH-═H2O |