题目内容
7.已知在溶液中可发生如下反应:Br2+2Fe2+═2Fe3++2Br-,Cl2+2Br-═Br2+2Cl-.由此推断Br2、Cl2、Fe3+的氧化性由强到弱的顺序是( )| A. | Cl2、Br2、Fe3+ | B. | Br2、Cl2、Fe3+ | C. | Fe3+、Cl2、Br2 | D. | Cl2、Fe3+、Br2 |
分析 氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性.
解答 解:反应Br2+2Fe2+=2Fe3++2Br-中,氧化剂是Br2,氧化产物是Fe3+,所以氧化性:Br2>Fe3+,
反应Cl2+2Br-=2Cl-+Br2中,氧化剂是Cl2,氧化产物是Br2,所以氧化性:Cl2>Br2,
综上,氧化性顺序为Cl2>Br2>Fe3+.
故选A.
点评 本题考查氧化性强弱的判断规律:氧化剂的氧化性强于氧化产物的氧化性,可以根据所学知识进行回答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.体积为V(mL)、密度为ρ(g•cm-3)的溶液,含有摩尔质量为M的溶质质量为m(g),物质的量浓度为c,质量分数为w.下列表达式中不正确的是( )
| A. | c=$\frac{1000ρw}{M}$ | B. | m=V•ρ•$\frac{w}{100}$ | C. | w=$\frac{cM}{1000ρ}$ | D. | c=$\frac{1000m}{MV}$ |
18.汽车上的催化转化器可将尾气中的主要污染物转化成无毒物质,反应为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-aKJ/mol (a>0)在某温度时,用气体传感器测得不同时间的NO和CO浓度如表.经分析,得出结论正确的是( )
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol.L-1 | 10.0 | 4.05 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/10-3mol.L-1 | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
| A. | 该反应的平衡常数和转化反应速率在夏季时比冬季时高 | |
| B. | 2~3s间的平均反应速率v(NO)=0.9 moI/(L•s) | |
| C. | 该温度下,此反应的平衡常数K=500 | |
| D. | 若该催化转化器气舱容积为2L,则达到平衡时反应放出热量0.9aJ |
2.高氯酸铜[Cu(ClO4)2•6H2O]易溶于水,120℃开始分解,常用于生产电极和作催化剂等.可由氯化铜通过下列反应制备:2CuCl2+2Na2CO3+H2O═Cu2(OH)2CO3↓+CO2↑+4NaCl;Cu2(OH)2CO3+4HClO4+9H2O═2Cu(ClO4)2•6H2O+CO2↑.HClO4是易挥发的发烟液体,温度高于130℃易爆炸.下表列出相应金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1mol•L-1):
(1)将CuCl2和Na2CO3用研钵分别研细,加入适量的沸水,搅拌,加热成蓝棕色溶液.静置、冷却、过滤、洗涤得蓝色Cu2(OH)2CO3沉淀.
①把反应物研细的目的是增大反应物之间的接触面积,使反应速率增大.
②检验沉淀是否洗涤干净,应选用试剂是HNO3和AgNO3溶液.
(2)向Cu2(OH)2CO3沉淀中滴加稍过量的HClO4小心搅拌,适度加热后得到蓝色Cu(ClO4)2溶液同时会产生大量的白雾.
①大量的白雾的成分是HClO4(填化学式).
②适度加热但温度不能过高的原因是防止HClO4、Cu(ClO4)2分解.
(3)25℃时,若调节溶液pH=3,则溶液中的Fe3+的物质的量浓度为2.64×10-6mol•L-1.(已知25℃时,Fe(OH)3的Ksp=2.64×10-39)
(4)某研究小组欲用粗CuCl2固体(含Fe2+)制备纯净的无水氯化铜固体.请补充完整由粗CuCl2固体制备纯净的无水氯化铜固体的实验步骤(可选用的试剂:蒸馏水、稀盐酸、双氧水溶液和氨水):①将粗CuCl2固体溶于蒸馏水,滴入少量的稀盐酸;②加入适量双氧水溶液并充分混合,再加入适量氨水调节溶液pH至3.2~4.7,过滤;③将滤液将滤液加热浓缩,冷却结晶,过滤、(冰水)洗涤,干燥,得到CuCl2•2H2O晶体;④将将 CuCl2•2H2O晶体在HCl气氛中加热至质量不再变化为止,得到无水氯化铜固体.
| 金属离子 | 开始沉淀 | 沉淀完全 |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.7 | 6.7 |
①把反应物研细的目的是增大反应物之间的接触面积,使反应速率增大.
②检验沉淀是否洗涤干净,应选用试剂是HNO3和AgNO3溶液.
(2)向Cu2(OH)2CO3沉淀中滴加稍过量的HClO4小心搅拌,适度加热后得到蓝色Cu(ClO4)2溶液同时会产生大量的白雾.
①大量的白雾的成分是HClO4(填化学式).
②适度加热但温度不能过高的原因是防止HClO4、Cu(ClO4)2分解.
(3)25℃时,若调节溶液pH=3,则溶液中的Fe3+的物质的量浓度为2.64×10-6mol•L-1.(已知25℃时,Fe(OH)3的Ksp=2.64×10-39)
(4)某研究小组欲用粗CuCl2固体(含Fe2+)制备纯净的无水氯化铜固体.请补充完整由粗CuCl2固体制备纯净的无水氯化铜固体的实验步骤(可选用的试剂:蒸馏水、稀盐酸、双氧水溶液和氨水):①将粗CuCl2固体溶于蒸馏水,滴入少量的稀盐酸;②加入适量双氧水溶液并充分混合,再加入适量氨水调节溶液pH至3.2~4.7,过滤;③将滤液将滤液加热浓缩,冷却结晶,过滤、(冰水)洗涤,干燥,得到CuCl2•2H2O晶体;④将将 CuCl2•2H2O晶体在HCl气氛中加热至质量不再变化为止,得到无水氯化铜固体.
12.下列混合物的分离和提纯方法中,主要是从溶解性的角度考虑的是( )
| A. | 蒸发 | B. | 蒸馏 | C. | 升华 | D. | 萃取 |
19.只用溴水就可以将下列物质鉴别出来的是( )
| A. | NaCl溶液、NaBr溶液、NaI溶液 | B. | 水、CCl4、苯 | ||
| C. | AgNO3溶液、NaOH溶液、KI-淀粉溶液 | D. | Na2SO4、NaCl溶液、KI-淀粉溶液 |
17.标准状况下两个容积相等的储气瓶,一个装有CH4,另一个装有CO和CO2的混合气体,两瓶内的气体,一定相同的是( )
| A. | 质量 | B. | 原子总数 | C. | 碳原子数 | D. | 密度 |
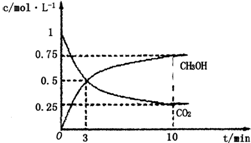 在lL的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
在lL的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示: .
.