题目内容
【题目】5.00g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
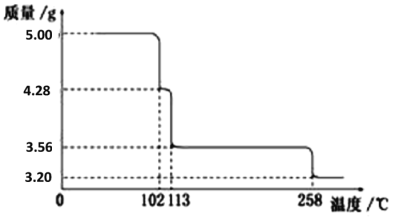
请回答下列问题:
(1)试确定110℃时固体物质的化学式_____________________;
(2)取200℃所得样品,加热至280oC, 该反应的化学方程式为:_______________;
(3)将280oC所得产物在570℃下灼烧得到的主要产物是1.60g黑色粉末和一种氧化性气体,黑色粉末的化学式为______________。
(4)把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体其存在的最高温度是______;
(5)天平两端各放一只质量相等的烧杯,内盛等体积等浓度的足量稀盐酸,将物质的量都为amol的铝和镁分别放入左盘和右盘的烧杯中,反应完毕后,在哪一盘的烧杯中加入多少克同种金属才能平衡 ________。
【答案】CuSO4·3H2O CuSO4·H2O![]() CuSO4+H2O CuO 102℃ 右盘 24a/11g镁
CuSO4+H2O CuO 102℃ 右盘 24a/11g镁
【解析】
由图分析可知CuSO4·5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解,根据分解前后固体质量的变化即可确定此时固体物质的化学式,据此解答。
(1)CuSO4·5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,102℃时固体质量减少5.00g-4.28g=0.72g,即产生水的物质的量是0.72g÷18g/mol=0.04mol,原固体的物质的量是5.00g÷250g/mol=0.02mol,共含有0.1mol水,则此时晶体中水的物质的量是0.1mol-0.04mol=0.06mol,所以结晶水和硫酸铜的物质的量之比是0.06:0.02=3:1,则110℃时固体物质的化学式CuSO4·3H2O;
(2)113℃时固体质量减少5.00g-3.56g=1.44g,即产生水的物质的量是1.44g÷18g/mol=0.08mol,则此时晶体中水的物质的量是0.1mol-0.08mol=0.02mol,所以结晶水和硫酸铜的物质的量之比是0.02:0.02=1:1,则113℃时固体物质的化学式CuSO4·H2O;258℃时固体质量减少5.00g-3.20g=1.8g,即产生水的物质的量是1.8g÷18g/mol=0.1mol,则此时晶体中水的物质的量是0.1mol-0.1mol=0,所以258℃时固体物质的化学式CuSO4,因此取200℃所得样品,加热至280oC时反应的化学方程式为CuSO4·H2O![]() CuSO4+H2O;
CuSO4+H2O;
(3)0.02mol胆矾可以得到0.02mol氧化铜,质量是0.02mol×80g/mol=1.60g,所以温度为570℃灼烧得到的黑色粉末应是CuO,氧化性气体则为SO3;
(4)把该黑色粉末溶解于稀硫酸中生成硫酸铜和水,经浓缩、冷却,有晶体析出,得到的晶体为CuSO45H2O,根据图像可知其存在的最高温度是102℃;
(5)根据题意,物质的量分别都为a mol的铝和镁两种金属,分别发生反应
2Al+6HCl=2AlCl3+3H2↑ 增重
2mol 2×27g-3×2g=48g
amol 24ag
Mg+2HCl=MgCl2+H2↑ 增重
1mol 24g-2g=22g
amol 22ag
则右盘增重小,所以右盘的烧杯轻,设应在右盘加入xmol镁才能平衡,根据方程式可知
Mg+2HCl=MgCl2+H2↑ 增重
1mol 24g-2g=22g
(a+x)mol 22(a+x)g
因此有22(a+x)g=24ag
解得x=a/11
即应在右盘加入24a/11克镁才能平衡。