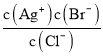题目内容
【题目】硫代硫酸钠(Na2S2O3)是重要的化工原料。具有较强的还原性,可用于棉织物漂白后的脱氯剂,定量分析中的还原剂。易溶于水,不溶于乙醇。Na2S2O35H2O于40~45℃熔化,48℃分解。实验室中常用亚硫酸钠和硫磺制备Na2S2O35H2O。制备原理为:Na2SO3+S+5H2O═Na2S2O35H2O。某化学兴趣小组在实验室制备硫代硫酸钠晶体并探究其化学性质。
Ⅰ.实验室制取Na2S2O35H2O晶体的步骤如下:
①称取12.6 g Na2SO3于烧杯中,溶于80.0 mL水。
②另取4.0 g硫粉,用少许乙醇润湿后,加到上述溶液中。
③水浴加热(如图1所示,部分装置略去),微沸,反应约1小时后过滤。
④滤液在经过蒸发浓缩、冷却结晶后析出Na2S2O35H2O晶体。
⑤进行减压过滤(如图2所示)、乙醇洗涤并干燥。请回答:
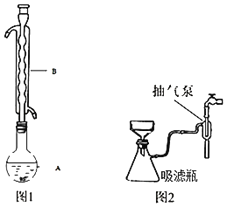
(1)仪器B的名称是_____。
(2)步骤④在浓缩过程中不能蒸发过度,其原因是_____。步骤⑤如欲停止抽滤,应先将吸滤瓶支管上的橡皮管拔下,再关抽气泵,其原因是_____。
(3)洗涤时为尽可能避免产品损失应选用的试剂是_____。
A.水 B.乙醇 C.氢氧化钠溶液 D.稀盐酸
Ⅱ.设计以下实验流程探究Na2S2O3的某些化学性质
![]()
(4)实验①Na2S2O3溶液pH=8的原因是_____(用离子方程式表示)。
(5)写出实验②中发生的离子反应方程式_____。
Ⅲ.用Na2S2O3的溶液测定溶液中ClO2的物质的量浓度,可进行以下实验。
步骤1:准确量取ClO2溶液10.00mL,稀释成100mL试样。
步骤2:量取V1 ML试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟(已知:ClO2+I﹣+H+—I2+Cl﹣+H2O 未配平)。
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。
(6)滴定终点现象是_____。根据上述步骤计算出原ClO2溶液的物质的量浓度为_____ mol/L(用含字母的代数式表示)。
【答案】球形冷凝管 避免温度高于48℃,Na2S2O35H2O发生分解 避免发生水倒吸 B S2O32﹣+H2OHS2O3﹣+OH﹣ S2O32﹣+5H2O+4Cl2+2Ba2+=2BaSO4↓+8Cl﹣+10H+ 溶液蓝色褪去,并在半分钟内不恢复 ![]()
【解析】
(1)、根据装置图可知,仪器B为球形冷凝管;
(2)、根据题干信息‘Na2S2O35H2O于40~45℃熔化,48℃分解’解答;停止抽滤时,应先将吸滤瓶支管上的橡皮管拔下,再关抽气泵,是为了避免发生水倒吸;
(3)、硫粉难溶于水、微溶于乙醇,乙醇湿润可以使硫粉易于分散到溶液中,硫在酒精中微溶,可以增大接触面积,提高反应速率;
(4)、常温下,由pH=8,是Na2S2O3为强碱弱酸盐,水解呈碱性;
(5)、加入足量氨水同时加入氯化钡溶液,氯水具有氧化性,Na2S2O3具有还原性,发生氧化还原反应,生成SO42-和Cl-,生成的SO42-再与Ba2+反应;
(6)、滴定终点时Na2S2O3溶液将碘全部还原,以淀粉溶液作指示剂,溶液蓝色褪去;由方程式2ClO2+10I- +8H+=5I2+2Cl-+4H2O、I2+2S2O32-=2I-+S4O62-得关系式ClO2~52S2O32-, n (2S2O32-) =cV2×10-3mol,所以V1mL ClO2的溶液中含有的ClO2的物质的量为2cV2×10-4mol,根据c=![]() 计算出原ClO2溶液的物质的量浓度。
计算出原ClO2溶液的物质的量浓度。
(1)由装置图可知仪器B为球形冷凝管,故答案为:球形冷凝管;
(2)加热时应避免温度高于48℃,Na2S2O35H2O发生分解,抽滤时应避免倒吸,如欲停止抽滤,应先将吸滤瓶支管上的橡皮管拔下,再关抽气泵,其原因是避免发生水倒吸,
故答案为:避免温度高于48℃,Na2S2O35H2O发生分解;避免发生水倒吸;
(3)洗涤时为尽可能避免产品损失应选用乙醇,故答案为:B;
(4)Na2S2O3为强碱弱酸盐,水解呈碱性,离子方程式为S2O32﹣+H2OHS2O3﹣+OH﹣,
故答案为:S2O32﹣+H2OHS2O3﹣+OH﹣;
(5)实验②中发生的离子反应方程式为S2O32﹣+5H2O+4Cl2+2Ba2+=2BaSO4↓+8Cl﹣+10H+,
故答案为:S2O32﹣+5H2O+4Cl2+2Ba2+=2BaSO4↓+8Cl﹣+10H+;
(6)滴定终点,溶液蓝色褪色,且半分钟内不恢复,反应的关系式为2ClO2~5I2~10S2O32﹣,n(Na2S2O3)=V2c×10﹣3mol,则c(ClO2)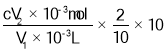 =
=![]() mol/L,
mol/L,
故答案为:溶液蓝色褪去,并在半分钟内不恢复;![]() 。
。