题目内容
17.氯化铁是常用的水处理剂,某化学研究性学习小组模拟工业流程制备无水FeCl3,经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.
(1)各装置正确的连接顺序是(均填字母):DBAC;其中需要加热的是C.
(2)连接好仪器后必须先进行的操作是检查气密性.
(3)D中发生反应的化学方程式2KMnO4+16HCl(浓)=2KCI+2MnCl2+5Cl2↑+8H2O.
(4)A装置中浓硫酸的作用是干燥气体;同时A装置的另一作用是防止堵塞.
(5)C装置中干燥管的作用是防止空气中的水蒸汽进入收集器中,使氯化铁潮解变质.
(6)该方案有一处明显的缺陷,改进的措施是干燥管后连接盛有碱溶液的烧杯,吸收多余的氯气.
分析 本题是模拟工业流程制备无水FeCl3,因无水FeCl3在空气中易潮解,加热易升华,同时考虑到产品的纯度,因此操作过程中要提供无氧和干燥环境,同时利用冷凝的方式收集生成的氯化铁,考虑到实验的尾气对环境有污染,故要有尾气处理装置.
(1)根据Cl2的制备、除杂原理进行选择仪器装置,整套装置中只有与铁反应时需要加热;
(2)因需要制备气体,并且利用气体参与反应,整套装置需要气密性比较好;
(3)D中是利用高锰酸钾氧化HCl制得氯气,同时得到MnCl2和KCl;
(4)A中的浓硫酸可以干燥氯气,同时也是一个安全装置,可以平衡压强;
(5)因生成的氯化铁很容易潮解,故无水氯化钙可以防止空气中的水进入反应容器中;
(6)整套装置中没有对氯气的尾气进行处理,需要增加尾气处理装置.
解答 解:(1)D装置制得的氯气,经过B装置除去挥发的HCl,C装置的干燥,再进入C装置与铁粉反应,连接顺序为DBAC,整套装置只有C装置需要加热,故答案为:DBAC;C;
(2)连接好仪器后必须先进行的操作是检验装置气密性,故答案为:检查气密性;
(3)D中发生的化学方程式为2KMnO4+16HCl(浓)=2KCI+2MnCl2+5Cl2↑+8H2O,故答案为:2KMnO4+16HCl(浓)=2KCI+2MnCl2+5Cl2↑+8H2O;
(4)A装置还是一个安全装置,可以防止堵塞,故答案为:防止堵塞;
(5)氯化钙可以吸水,防止空气中的水进入反应容器中,避免氯化铁潮解,故答案为:防止空气中的水蒸汽进入收集器中,使氯化铁潮解变质;
(6)为了吸收氯气的尾气,在C装置后接一个盛有碱溶液的烧杯,故答案为:干燥管后连接盛有碱溶液的烧杯,吸收多余的氯气.
点评 本题考查氯气的实验室制法及氯气的性质,涉及实验的操作规范及尾气的处理,难度不大,建议复习时要重视基础知识的学习,并提高分析问题和解决问题的能力.

 特高级教师点拨系列答案
特高级教师点拨系列答案
可能用到的有关数据如下:
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是直形冷凝器.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加
C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为
 .
.(4)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(5)分离提纯过程中加入无水氯化钙的目的是干燥.
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶
D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是C(填正确答案标号).
A.41% B.50%C.61% D.70%
| 相关实验 | 预期目的 | |
| A | 试样加水溶解后,再加入足量Ca(OH)2溶液,有白色沉淀生成 | 检验NaHCO3固体中是否含 Na2CO3 |
| B | 向少量燃尽火柴头的浸泡液中滴加足量稀HNO3、AgNO3 | 验证火柴头含有氯元素 |
| C | 加入饱和Na2CO3溶液,充分振荡,静置、分层后,分液 | 除去乙酸乙酯中的乙酸 |
| D | 两支试管中装有等体积、等浓度的 H2O2溶液,向其中一支试管中加入 FeCl3溶液 | 探究FeCl3溶液对H2O2分解速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
 如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol•L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒.
如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol•L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒. 图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.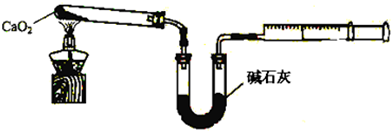
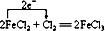 .
.