题目内容
【题目】一定条件下正丁烷(CH3CH2CH2CH3)易发生两种裂解反应:
Ⅰ.CH3CH2CH2CH3 (g)![]() CH3CH=CH2(g)+CH4(g) △H1=+ 61.31 kJ·mol-1
CH3CH=CH2(g)+CH4(g) △H1=+ 61.31 kJ·mol-1
Ⅱ.CH3CH2CH2CH3(g)![]() CH2=CH2(g)+CH3CH3(g) △H2=-56.00 kJ·mol-1
CH2=CH2(g)+CH3CH3(g) △H2=-56.00 kJ·mol-1
(1)维持体系温度T不变,总压p恒定时,体积为V1 L的正丁烷发生裂解反应,一段时间平衡后气体体积变为V2 L,此时正丁烷的转化率a(正丁烷)=________;维持体系温度不变,向体系中充入一定量的水蒸气(水蒸气在该条件下不参与反应),再次平衡后正丁烷的转化率将________(填“增大”、“不变”或“减小”),原因为____________________________________________________。
(2)一定温度下向体积为2L的密闭容器中充入0.2molCH3CH=CH2和0.5 molCH4发生反应CH3CH=CH2(g) +CH4(g)![]() CH2=CH2(g)+CH3CH3(g) △H3;5 min后达到平衡状态,容器内剩余CH3CH =CH2的物质的量为0.1mol。
CH2=CH2(g)+CH3CH3(g) △H3;5 min后达到平衡状态,容器内剩余CH3CH =CH2的物质的量为0.1mol。
①△H3=________。
②5min内该反应的反应速率v(CH4)=________。
③保持温度不变,向某密闭容器中充入等物质的量的CH3CH =CH2和CH4,平衡后容器内CH4的体积分数为________。
(3)将0.1molCH2=CH2完全燃烧后的气体通入100mL一定浓度的NaOH溶液中,并将所得溶液稀释至1L。最终所得溶液中CO32-、HCO3-、H2CO3 三者所占物质的量分数随原NaOH溶液浓度变化的关系如图所示:
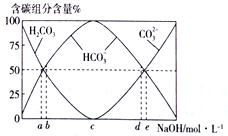
其中图中表示原氢氧化钠溶液浓度为3mol·L-1的是________(选填“a”、“b”、“c”、“d”或“e” ),
(4)以氢氧化钠溶液为电解质溶液,CH2=CH2 燃料电池的负极反应式为_________________。
【答案】 ![]() 增大 充入水蒸气扩大容器体积,所以平衡会向正向移动 -117.31kJ·mol-1 0.01mol·L-1·min-1 33.3% d CH2=CH2+16OH--12e-= 2CO32-+10H2O
增大 充入水蒸气扩大容器体积,所以平衡会向正向移动 -117.31kJ·mol-1 0.01mol·L-1·min-1 33.3% d CH2=CH2+16OH--12e-= 2CO32-+10H2O
【解析】(1). 在等温等压的条件下,气体的体积之比等于物质的量之比,根据方程式可得消耗的V(CH3CH2CH2CH3)=(V2-V1)L,此时正丁烷的转化率α(正丁烷)= (V2-V1)÷V1,维持体系温度不变,向体系中充入一定量的水蒸气(水蒸气在该条件下不参与反应),相当于增大容器的体积,平衡正向移动,再次平衡后正丁烷的转化率将增大,故答案为: ![]() ;增大;
;增大;
(2). ①. 已知Ⅰ.CH3CH2CH2CH3(g)![]() CH3CH=CH2(g)+CH4(g)△H1=+61.31kJ·mol-1
CH3CH=CH2(g)+CH4(g)△H1=+61.31kJ·mol-1
Ⅱ.CH3CH2CH2CH3(g)![]() CH2=CH2(g)+CH3CH3(g)△H2=-56.00kJ·mol-1
CH2=CH2(g)+CH3CH3(g)△H2=-56.00kJ·mol-1
根据盖斯定律可知,II-I得CH3CH=CH2(g)+CH4(g)![]() CH2=CH2(g)+CH3CH3(g)△H3,则△H3=△H2-△H1=-117.31kJ·mol-1,故答案为:-117.31kJ·mol-1;
CH2=CH2(g)+CH3CH3(g)△H3,则△H3=△H2-△H1=-117.31kJ·mol-1,故答案为:-117.31kJ·mol-1;
②. 达到平衡时容器内剩余CH3CH =CH2的物质的量为0.1mol,说明CH3CH =CH2消耗了0.2mol-0.1mol=0.1mol,根据反应方程式可知,CH4也消耗了0.1mol,则5min内该反应的反应速率v(CH4)=0.1mol÷2L÷5min=0.01mol·L-1·min-1,故答案为:0.01mol·L-1·min-1;
③. 达到平衡时CH3CH=CH2(g)、CH4(g)、CH2=CH2(g)、CH3CH3(g)的物质的量分别为0.1mol、0.4mol、0.1mol、0.1mol,计算可得该温度下反应的平衡常数K=0.25,保持温度不变,设向某密闭容器中各充入1mol的CH3CH=CH2和CH4,平衡后二者的物质的量分别为(1-x)mol,根据K=0.25可得:x2÷(1-x)2=0.25,x=1/3,则平衡后CH4的体积分数为33.3%,故答案为:33.3%;
(3). 若原氢氧化钠溶液浓度为3mol·L-1,则100mL该溶液中含有NaOH的物质的量为0.3mol,0.1molCH2=CH2完全燃烧后生成0.2mol CO2,将CO2通入该NaOH溶液中,反应得到Na2CO3和NaHCO3的物质的量之比为1:1的混合溶液,混合溶液呈碱性,CO32-的水解程度大于HCO3-的水解程度,所以CO32-的物质的量比HCO3-的少,应选d点,故答案为:d;
(4). 以氢氧化钠溶液为电解质溶液,CH2=CH2为燃料,CH2=CH2在负极失去电子生成CO32-和H2O,负极反应式为CH2=CH2+16OH--12e-=2CO32-+10H2O,故答案为:CH2=CH2+16OH--12e-=2CO32-+10H2O。