题目内容
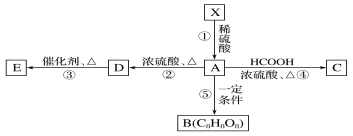
【题目】(1)反应A+B→C(放热)分两步进行①A+B→X(吸热);②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是______。
A.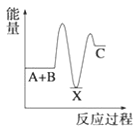 B.
B.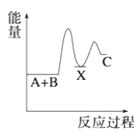
C.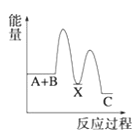 D.
D.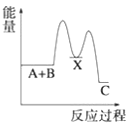
(2)①合成氨工业中,合成塔中每产生2molNH3,放出92.2kJ热量,已知(见图1):则1molN﹣H键断裂吸收的能量约等于______kJ。

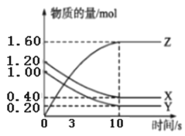
②图2t2时刻改变的条件是______,t3时刻改变的条件是______。
③某温度下,若把10molN2与30molH2置于体积为10L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则氮气的转化率______。
④绝热恒容条件下,可以作为判断该反应达到平衡状态的依据是_____。
A.容器内气体的总压强保持不变
B.H2、N2的反应速率比为3∶1
C.容器内气体的平均摩尔质量保持不变
D.容器内气体的温度保持不变E.容器内气体的密度保持不变
【答案】D 391 减小压强 升高温度 33.3% ACD
【解析】
(1) A+B→C为放热反应,则A+ B的总能量大于生成C的总能量,所以A、B错误;
A+B→X (吸热),则X的能量大于A+B的总能量, X→C (放热),则X的能量大于C的总能量,所以C错误;故选D;
(2) ①工业合成氨反应为:3H2+N2![]() 2NH3,反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量=3×436+945.8-6×N-H键键能=-92.2 kJ;可以算出N-H键键能为+391kJ;
2NH3,反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量=3×436+945.8-6×N-H键键能=-92.2 kJ;可以算出N-H键键能为+391kJ;
②t2时刻,v正、v逆都减小,说明改变的条件是降温或减压,又因为此时平衡向逆向移动,所以改变的条件只能是减压;
③设N2的浓度为x
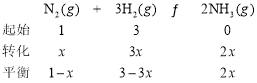
平衡时,混合气体中氨的体积分数为20%,可得:![]() ,解得
,解得![]() ;
;
④A.由于反应前后系数之和不同,压强是变量,压强不变时,反应达到平衡,A正确;
B.由反应系数可知,H2、N2的系数比为3∶1,根据反应速率之比等于系数比,H2、N2的反应速率比一直是3∶1,是定值,不能判断平衡,B错误;
C.容器内气体的平均摩尔质量![]() ,根据质量守恒,m为定值,但n是变量,故M也为变量,可以判定平衡,C正确;
,根据质量守恒,m为定值,但n是变量,故M也为变量,可以判定平衡,C正确;
D.由于正反应放热,随着反应的进行,温度在不断变化,所以温度可用来判定平衡,D正确;
E.容器内气体的密度![]() ,根据质量守恒,m为定值,容器体积固定,V也为定值,故ρ是定值,不能判定平衡,E错误;
,根据质量守恒,m为定值,容器体积固定,V也为定值,故ρ是定值,不能判定平衡,E错误;
故选ACD。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案