题目内容
【题目】蛋白质中含有C、H、O、N、S等元素,食物中的铁主要以三价铁与蛋白质和羧酸结合成络合物的形式存在。
(1)在蛋白质中涉及的氮、氧元素电负性由小到大的顺序是___;基态硫原子的价电子排布式为______。
(2)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的一种分子为____(填化学式)。1 mol CN-中含有的π键的数目为____。
(3)蛋白质分子中氨基(—NH2)氮原子的轨道杂化类型是_____;血液中有一种含铜的呈蓝色的蛋白质分子,与Cu同周期且最外层电子数相等的元素还有______(填元素符号)。
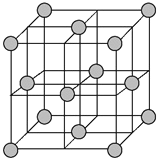
(4)铜晶体为面心立方最密堆积,即在晶体结构中可以分割出一块正立方体的结构单元,金属原子处于正立方体的八个顶点和六个面上,已知铜的原子半径为127.8 pm,列式计算晶体铜的密度:ρ=___g·cm-3(列出计算式即可)。
![]()
【答案】N<O 3s23p4 CO2或N2O 2NA sp3 K、Cr ![]()
【解析】
(1)非金属性越强,电负性越大;S元素处于第三周期VIA族;
(2)与SCN-互为等电子体,应含有3个原子,且最外层电子数相同;CN-与N2互为等电子体,二者结构相似,故 CN-离子中形成C≡N三键;
(3)蛋白质分子中氨基(-NH2)氮原子形成3个σ键,含有1对孤对电子,N原子杂化轨道数目为4;与Cu同周期且最外层电子数相等的元素原子外围电子排布为4s1、3d54s1;
(4)晶胞为面心立方密堆积,晶胞面对角线上的Cu原子相邻,则晶胞棱长为127.8pm×4×![]() =
=![]() ×127.8pm,根据均摊法计算晶胞中Cu原子数目,表示出晶胞质量,再根据ρ=
×127.8pm,根据均摊法计算晶胞中Cu原子数目,表示出晶胞质量,再根据ρ=![]() 计算晶胞密度。
计算晶胞密度。
(1)非金属性越强,电负性越大,故电负性:N<O;S元素处于第三周期VIA族,基态硫原子的价电子排布式为3s23p4;
(2)与SCN-互为等电子体,应含有3个原子,且最外层电子数相同,故为CO2或N2O等; CN-与N2互为等电子体,二者结构相似,故 CN-离子中形成C≡N三键,1mol CN-中含有的π键的数目为2NA;
(3)蛋白质分子中氨基(-NH2)氮原子形成3个σ键,含有1对孤对电子,N原子杂化轨道数目为4,N原子轨道的杂化类型是sp3;与Cu同周期且最外层电子数相等的元素原子外围电子排布为4s1、3d54s1,分别为K、Cr;
(4)晶胞为面心立方密堆积,晶胞面对角线上的Cu原子相邻,则晶胞棱长为127.8pm×4×![]() =
=![]() ×127.8pm,晶胞中Cu原子数目为8×
×127.8pm,晶胞中Cu原子数目为8×![]() +6×
+6×![]() =4,晶胞质量为4×
=4,晶胞质量为4×![]() g,则晶胞密度4×
g,则晶胞密度4×![]() g÷(
g÷(![]() ×127.8×10-10cm)3=
×127.8×10-10cm)3=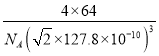 gcm-3。
gcm-3。