题目内容
【题目】如图为原电池装置示意图。

(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是____(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式:_____。
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。写出B电极反应式:____;该电池在工作时,A电极的质量将____(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1molH2SO4,则转移电子的数目为_____。
(3)如图是在金属锌板上贴上一张用某溶液浸湿的滤纸。
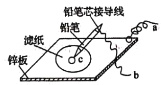
若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现______色,铅笔芯c点处的电极反应式为______。
【答案】B Al-3e-+4OH-=AlO2-+2H2O PbO2+SO42-+4H+=PbSO4+2H2O 增加 0.1NA 红 O2+4e-+2H2O=4OH-
【解析】
(1)铝片和铜片插入浓HNO3中,铝会钝化,此时铜为负极,铝是正极;插入NaOH溶液中,铜不反应,此时铝是负极,铜是正极,B正确;插入烧碱溶液中,铝作负极失电子,负极反应式为: Al-3e-+40H-=AlO2-+2H2O;
(2)根据Pb+PbO2+2H2SO4=2PbSO4+2H2O可知,PbO2中Pb元素化合价由+4变为+2,得电子作正极,电极反应式为: PbO2+SO42- +4H++2e- =PbSO4+2H2O;
Pb失电子结合SO42-生成PbSO4,所以质量增加;每消耗2molH2SO4转移2mol电子,所以消耗0.1molH2SO4时转移电子的数目为0.1NA;
(3)若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a.b直接相连,则锌板为负极,铅笔为正极。O2反应生成氢氧根,氢氧根使酚酞变红,因此滤纸出现红色。铅笔芯c点处的电极反应式为O2 +4e-+2H2O=4OH-;

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案