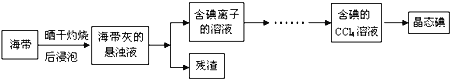
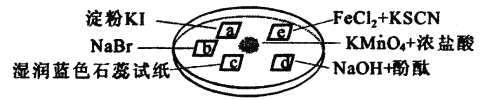
题目内容
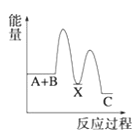
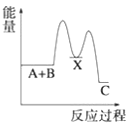
【题目】工业上烟气脱氮的原理![]()
(1)该反应化学平衡常数K的表达式为____________。温度升高,K值___________(选填“增大”、“减小”、“不变”)。如果平衡常数K值增大,对_______(填“正反应”或“逆反应”)的速率影响更大。
(2)若反应在恒容条件下进行,能说明反应已经达到平衡状态的是______(填序号)
a.容器内混合物的质量不变 b.容器内气体的压强不变
c.反应消耗0.5mol NO的同时生成1mol N2 d.![]() 的浓度不变
的浓度不变
(3)向2 L密闭容器中加入反应物,10 min后达到平衡,测得平衡时气体的物质的量增加了0.2mol,则用![]() 表示的平均反应速率为__________。
表示的平均反应速率为__________。
(4)如图是P1压强下NO的转化率随反应时间(t)的变化图,请在图中画出其他条件不变情况下,压强为![]() 下NO的转化率随反应时间变化的示意图。
下NO的转化率随反应时间变化的示意图。
 ______
______
(5)工业合成氨的反应温度选择500℃左右的原因是_______________。
(6)写出反应物中的氨气的电子式______;其空间构型为______;它常用来生产化肥![]() 。
。![]() 溶液显__________性;常温下将等体积等浓度的氨水和
溶液显__________性;常温下将等体积等浓度的氨水和![]() 溶液混合,pH>7,溶液中
溶液混合,pH>7,溶液中![]() 浓度由大到小的关系是_______________。
浓度由大到小的关系是_______________。
【答案】![]() 减小 逆反应 bd 0.03mol/(L·min)
减小 逆反应 bd 0.03mol/(L·min)  催化剂在500℃左右具有最佳活性
催化剂在500℃左右具有最佳活性 ![]() 三角锥形 酸性
三角锥形 酸性 ![]()
【解析】
(1)化学平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,该反应为放热反应,升高温度,对逆反应速率影响更大,平衡向逆反应方向移动;
(2)反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,可以及由此衍生的一些量也不发生变化,由此进行判断;
(3)由平衡时气体的物质的量增加了0.2mol可知反应生成水的物质的量为0.6mol;
(4)该反应是一个气体体积增大的反应,增大压强,反应速率加快,达到平衡的时间减小,平衡向逆反应方向移动;
(5)工业合成氨的反应为放热反应,升高温度,平衡向逆反应方向移动,不利于增大氨气的产率,但500℃左右的温度是催化剂的活性温度,且反应速率较快;
(6)氨气为三角锥形的极性分子;氯化铵为强酸弱碱盐,铵根离子在溶液中水解使溶液呈酸性;常温下将等体积等浓度的氨水和氯化铵溶液混合溶液pH>7,说明氨水的电离大于铵根离子的水解。
(1)化学平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,则该反应化学平衡常数K的表达式为![]() ;该反应为放热反应,升高温度,对逆反应速率影响更大,平衡向逆反应方向移动,化学平衡常数减小,故答案为:
;该反应为放热反应,升高温度,对逆反应速率影响更大,平衡向逆反应方向移动,化学平衡常数减小,故答案为:![]() ;减小;逆反应;
;减小;逆反应;
(2)a、根据质量守恒,无论反应是否达平衡状态,混合物质量不变,容器的体积不变,所以混合气体的密度始终不变,容器内混合物的质量不变不能作为化学平衡状态的判断依据,故错误;
b、该反应是反应前后气体体积增大的反应,当压强不变时,各物质的浓度不再发生变化,容器内气体的压强不变能说明反应已经达到平衡状态,故正确;
c、反应消耗0.5mol NO和生成1mol N2均代表正反应速率,不能表示正逆反应速率相等,反应消耗0.5mol NO的同时生成1mol N2不能作为化学平衡状态的判断依据,故错误;
d、各物质的浓度不变说明反应达平衡状态,故正确;
bd正确,故答案为:bd;
(3)由化学方程式可知,反应生成3mol水,气体增加的物质的量为1mol,由平衡时气体的物质的量增加了0.2mol可知反应生成水的物质的量为3:1=n(H2O):0.2mol,解得n(H2O)=0.6mol,则10min后达到平衡,用水表示的平均反应速率为![]() =0.03mol/(L·min),故答案为:0.03mol/(L·min);
=0.03mol/(L·min),故答案为:0.03mol/(L·min);
(4)该反应是一个气体体积增大的反应,增大压强,反应速率加快,达到平衡的时间减小,平衡向逆反应方向移动,NO的转化率减小,则压强为P2时NO的转化率随反应时间变化的示意图为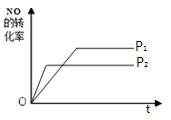 ,故答案为:
,故答案为: ;
;
(5)工业合成氨的反应为放热反应,升高温度,平衡向逆反应方向移动,不利于增大氨气的产率,但500℃左右的温度是催化剂的活性温度,且反应速率较快,故答案为:催化剂在500℃左右具有最佳活性;
(6)氨气为三角锥形的极性分子,电子式为![]() ;氯化铵为强酸弱碱盐,铵根离子在溶液中水解使溶液呈酸性;常温下将等体积等浓度的氨水和氯化铵溶液混合溶液pH>7说明氨水的电离大于铵根离子的水解,则溶液中
;氯化铵为强酸弱碱盐,铵根离子在溶液中水解使溶液呈酸性;常温下将等体积等浓度的氨水和氯化铵溶液混合溶液pH>7说明氨水的电离大于铵根离子的水解,则溶液中![]() 各微粒浓度由大到小的关系是
各微粒浓度由大到小的关系是![]() ,故答案为:
,故答案为:![]() 。
。

【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据:
实验编号 | 实验温度 | 试管中所加试剂及其用量 / mL | 溶液褪至无色所需时间/ min | |||
0.6mol/L H2C2O4 溶液 | H2O | 3mol/L H2SO4 稀溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请写出该反应的离子方程式_________,当该反应以表中数据反应完全时转移电子数为_______NA;
(2)V1=________ mL;
(3)根据上表中的实验①、②数据,可以得到的结论是________。
(4)探究温度对化学反应速率的影响,应选择________(填实验编号);
(5)该小组同学根据经验绘制了n(Mn 2+)随时间变化的趋势如图所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn 2+)随时间变化的实际趋势如图所示。

该小组同学根据如图所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再加入某种固体 | 溶液褪至无色所需时间 / min | |||
④ | 25 | 0.6mol/L H2C2O4 | H2O | 3mol/L H2SO4 | 0.05mol/L KMnO4溶液 | ||
2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t | ||
①小组同学提出的假设是_________。
②若该小组同学提出的假设成立,应观察到_______________________现象。