题目内容
【题目】甲醇合成反应及其能量变化如图a所示: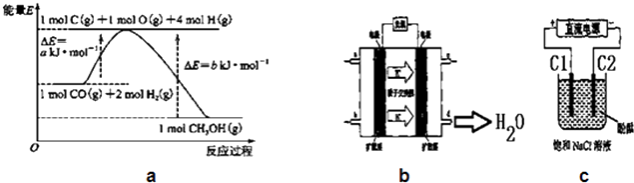
(1)写出合成甲醇的热化学方程式 .
(2)实验室在1L的密闭容器中进行模拟合成实验.将1mol CO和2molH2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
时间浓度(mol/L)温度 | 10min | 20min | 30min | 40min | 50min | 60min |
300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
在300℃反应开始10min内,H2的平均反应速率为v(H2)= .
(3)在500℃达到平衡时,平衡常数K= .
(4)在另一体积不变的密闭容器中,充入1.2mol CO和2.0mol H2 , 一定条件下达到平衡,测得容器中压强为起始压强的一半.计算该条件下H2的转化率为 .
(5)铜基催化剂具有活性高、选择性好和条件温和的特点,已广泛地使用于CO/CO2的加氢合成甲醇.使用铜基催化剂后,该反应中a的大小变化对反应热△H有无影响, . (填“有影响”或“无影响”)
(6)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图b所示.请写出从C口通入O2发生的电极反应式 .
(7)用上述电池做电源,用图c装置电解饱和食盐水(C1、C2均为石墨电极).①该反应的离子方程式 .
②电解开始后在电极的周围(填“C1”或“C2”)先出现红色.
【答案】
(1)CO(g)+2H2(g)=CH3OH(g)△H=﹣(b﹣a)KJ/mol
(2)0.08mol/(L?min)
(3)25
(4)80%
(5)无影响
(6)O2+4e﹣+4H+=2H2O
(7)2Cl﹣+2H2O ![]() 2OH﹣+H2↑+Cl2↑;C2
2OH﹣+H2↑+Cl2↑;C2
【解析】解:(1)由图可知,1molC(s)与2molH2(g)反应生成1molCH3OH(g)放出热量为(b﹣a)kJ,应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g)△H=﹣(b﹣a)KJ/mol;所以答案是:CO(g)+2H2(g)=CH3OH(g)△H=﹣(b﹣a)KJ/mol;(2)在300℃反应开始10min内,生成的甲醇为0.4mol,则v(CH3OH)= ![]() =0.04mol/(Lmin),H2的平均反应速率为v(H2)=2V(CH3OH)=0.08mol/(Lmin);
=0.04mol/(Lmin),H2的平均反应速率为v(H2)=2V(CH3OH)=0.08mol/(Lmin);
所以答案是:0.08mol/(Lmin);(3)500℃达到平衡时,40min处于平衡状态,平衡时甲醇的浓度为0.8mol/L,则:
CO(g)+2H2(g)=CH3OH(g)
起始量(mol/L):1 2 0
变化量(mol/L):0.8 1.6 0.8
平衡量(mol/L):0.2 0.4 0.8
平衡常数K= ![]() =
= ![]() =25,
=25,
所以答案是:25;(4)恒温恒容条件下,压强之比等于物质的量之比,平衡时混合气体总物质的量为(1.2mol+2.0mol)× ![]() =1.6mol,即混合气体减小的物质的量为1.6mol,
=1.6mol,即混合气体减小的物质的量为1.6mol,
CO(g)+2H2(g)=CH3OH(g)物质的量减小
2 2
1.6mol 1.6mol
故该条件下H2的转化率为= ![]() ×100%=80%;
×100%=80%;
所以答案是:80%;(5)反应中的a是反应的活化能,影响因素是催化剂,反应热只与始态与终态有关,与反应过程无关,所以对反应热的影响无关;所以答案是:无影响;(6)氧气发生还原反应,与通过质子交换膜的氢离子结合生成水,电极反应式为:O2+4e﹣+4H+=2H2O,所以答案是:O2+4e﹣+4H+=2H2O;(7)①电解饱和食盐水生成氢氧化钠、氢气和氯气,反应离子方程式为:2Cl﹣+2H2O ![]() 2OH﹣+H2↑+Cl2↑,所以答案是:2Cl﹣+2H2O
2OH﹣+H2↑+Cl2↑,所以答案是:2Cl﹣+2H2O ![]() 2OH﹣+H2↑+Cl2↑;②C1连接电源正极,为阳极,C2连接电源负极,为阴极,电解过程中,阳极氯离子失去生成氯气,阴极水电离的氢离子得到电子生成氢气,同时产生氢氧根离子,所以在阴极C2先变红,所以答案是:C2 .
2OH﹣+H2↑+Cl2↑;②C1连接电源正极,为阳极,C2连接电源负极,为阴极,电解过程中,阳极氯离子失去生成氯气,阴极水电离的氢离子得到电子生成氢气,同时产生氢氧根离子,所以在阴极C2先变红,所以答案是:C2 .
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效),以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

【题目】下表是元素周期表的一部分,已知⑥为短周期元素,其单质为淡黄色固体,据表回答有关问题:
① | ② | ||||||
③ | ④ | ⑤ | ⑥ | ⑦ | |||
⑧ | ⑨ |
(1)⑥的元素符号 , 画出其原子结构示意图
(2)元素①③⑧最外层电子数都为 , 在周期表中在同一列,称为元素,③的金属性⑧的金属性(填>、=、<).
(3)②⑦⑨元素的性依次减弱(填金属性、非金属性),⑤的氧化物是氧化物(填酸性、碱性或两性),写出其与③的氧化物水化物反应的化学方程式: .
