题目内容
【题目】下表是元素周期表的一部分,已知⑥为短周期元素,其单质为淡黄色固体,据表回答有关问题:
① | ② | ||||||
③ | ④ | ⑤ | ⑥ | ⑦ | |||
⑧ | ⑨ |
(1)⑥的元素符号 , 画出其原子结构示意图
(2)元素①③⑧最外层电子数都为 , 在周期表中在同一列,称为元素,③的金属性⑧的金属性(填>、=、<).
(3)②⑦⑨元素的性依次减弱(填金属性、非金属性),⑤的氧化物是氧化物(填酸性、碱性或两性),写出其与③的氧化物水化物反应的化学方程式: .
【答案】
(1)S;![]()
(2)1;碱金属;<
(3)非金属性;两性;Al2O3+2NaOH=2NaAlO2+H2O
【解析】解:⑥为短周期元素,其单质为淡黄色固体,则⑥为S元素,由元素的相对位置可知:①为Li、②为F、③为Na、④为Mg、⑤为Al、⑦为Cl、⑧为K、⑨为Br.(1)⑥为S元素,原子核外有16个电子,各层电子数为2、8、6,原子结构示意图为: ![]() ,所以答案是:S;
,所以答案是:S; ![]() ;(2)元素①③⑧均处于IA族,最外层电子数为1,称为碱金属元素,同主族自上而下金属性增强,故金属性③<⑧,所以答案是:1;碱金属;<;(3)同主族自上而下非金属性减弱,②⑦⑨元素的非金属性依次减弱,⑤的氧化物是氧化铝,属于两性氧化物,③的氧化物水化物为NaOH,二者反应生成偏铝酸钠与水,反应方程式是为:Al2O3+2NaOH=2NaAlO2+H2O,所以答案是:非金属性;两性;Al2O3+2NaOH=2NaAlO2+H2O.
;(2)元素①③⑧均处于IA族,最外层电子数为1,称为碱金属元素,同主族自上而下金属性增强,故金属性③<⑧,所以答案是:1;碱金属;<;(3)同主族自上而下非金属性减弱,②⑦⑨元素的非金属性依次减弱,⑤的氧化物是氧化铝,属于两性氧化物,③的氧化物水化物为NaOH,二者反应生成偏铝酸钠与水,反应方程式是为:Al2O3+2NaOH=2NaAlO2+H2O,所以答案是:非金属性;两性;Al2O3+2NaOH=2NaAlO2+H2O.

【题目】甲醇合成反应及其能量变化如图a所示: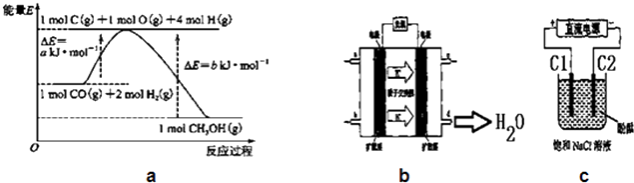
(1)写出合成甲醇的热化学方程式 .
(2)实验室在1L的密闭容器中进行模拟合成实验.将1mol CO和2molH2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
时间浓度(mol/L)温度 | 10min | 20min | 30min | 40min | 50min | 60min |
300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
在300℃反应开始10min内,H2的平均反应速率为v(H2)= .
(3)在500℃达到平衡时,平衡常数K= .
(4)在另一体积不变的密闭容器中,充入1.2mol CO和2.0mol H2 , 一定条件下达到平衡,测得容器中压强为起始压强的一半.计算该条件下H2的转化率为 .
(5)铜基催化剂具有活性高、选择性好和条件温和的特点,已广泛地使用于CO/CO2的加氢合成甲醇.使用铜基催化剂后,该反应中a的大小变化对反应热△H有无影响, . (填“有影响”或“无影响”)
(6)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图b所示.请写出从C口通入O2发生的电极反应式 .
(7)用上述电池做电源,用图c装置电解饱和食盐水(C1、C2均为石墨电极).①该反应的离子方程式 .
②电解开始后在电极的周围(填“C1”或“C2”)先出现红色.
