题目内容
【题目】对羟基扁桃酸是农药、药物、香料合成的重要中间体,它可由苯酚和乙醛酸在一定条件下反应制得。

下列有关说法不正确的是( )
A. 上述反应的原子利用率可达到100%
B. 在对羟基扁桃酸中有6种不同化学环境的氢原子
C. 对羟基扁桃酸可以发生加成反应、取代反应和缩聚反应
D. lmol对羟基扁桃酸与足量NaOH溶液反应,消耗3 mol NaOH
【答案】D
【解析】A. 该反应为加成反应,产物只有一种,所以原子利用率可达到100%,A正确;B. 在对羟基扁桃酸中有6种不同化学环境的氢原子,B正确;C. 对羟基扁桃酸分子中有苯环、酚羟基、醇羟基和羧基,可以发生加成反应、取代反应和缩聚反应,C正确;D. lmol对羟基扁桃酸与足量NaOH溶液反应,只有酚羟基和羧基能参与反应,所以可以消耗2 mol NaOH,D不正确。本题选D。

【题目】甲醇合成反应及其能量变化如图a所示: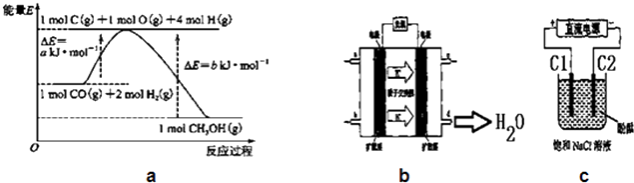
(1)写出合成甲醇的热化学方程式 .
(2)实验室在1L的密闭容器中进行模拟合成实验.将1mol CO和2molH2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
时间浓度(mol/L)温度 | 10min | 20min | 30min | 40min | 50min | 60min |
300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
在300℃反应开始10min内,H2的平均反应速率为v(H2)= .
(3)在500℃达到平衡时,平衡常数K= .
(4)在另一体积不变的密闭容器中,充入1.2mol CO和2.0mol H2 , 一定条件下达到平衡,测得容器中压强为起始压强的一半.计算该条件下H2的转化率为 .
(5)铜基催化剂具有活性高、选择性好和条件温和的特点,已广泛地使用于CO/CO2的加氢合成甲醇.使用铜基催化剂后,该反应中a的大小变化对反应热△H有无影响, . (填“有影响”或“无影响”)
(6)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图b所示.请写出从C口通入O2发生的电极反应式 .
(7)用上述电池做电源,用图c装置电解饱和食盐水(C1、C2均为石墨电极).①该反应的离子方程式 .
②电解开始后在电极的周围(填“C1”或“C2”)先出现红色.