题目内容
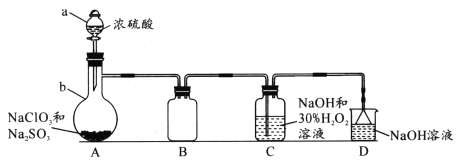
【题目】某小组同学利用舍勒发现氯气的方法制取氯气并探究其性质。

请回答:
(1)写出装置①中制取氯气化学反应方程式__________。在反应中,是利用了MnO2的_________ (填“氧化性”或“还原性”)。
(2)装置②中的现象是__________。
(3)③中溶液由无色变为橙黄色,发生反应的离子方程式是_________。
(4)用离子方程式解释④中NaOH溶液的作用____________。
(5)取一支试管,加入2 mL ③中橙黄色溶液,再滴入几滴KI-淀粉溶液,观察到溶液变为蓝色。通过以上实验,能否得出结论:Br2的氧化性强于I2 _________(能或否)。理由是_________。
【答案】MnO2+4HCl ![]() MnCl2+ Cl2 ↑+ 2H2O 氧化性 红色褪去 2Br- +Cl2 = Br2 + 2Cl- Cl2+2OH-=Cl-+ClO- +H2O 否 有可能是溶液中的多余的Cl2 (HClO)氧化了I-离子生成I2
MnCl2+ Cl2 ↑+ 2H2O 氧化性 红色褪去 2Br- +Cl2 = Br2 + 2Cl- Cl2+2OH-=Cl-+ClO- +H2O 否 有可能是溶液中的多余的Cl2 (HClO)氧化了I-离子生成I2
【解析】
装置①中制取氯气是二氧化锰和浓盐酸在加热条件反应生成氯化锰、氯气和水,氯气通入到湿润的有色布条中,有色布条褪色其实质是氯气与水反应生成的次氯酸漂白而褪色,氯气与溴化钠反应生成溴单质,多余的氯气用氢氧化钠溶液处理。
(1)装置①中制取氯气是二氧化锰和浓盐酸在加热条件反应生成氯化锰、氯气和水,其化学反应方程式MnO2+4HCl ![]() MnCl2+ Cl2 ↑+ 2H2O。在反应中,MnO2中锰元素化合价降低,作氧化剂,利用了MnO2的氧化性;故答案为:MnO2+4HCl
MnCl2+ Cl2 ↑+ 2H2O。在反应中,MnO2中锰元素化合价降低,作氧化剂,利用了MnO2的氧化性;故答案为:MnO2+4HCl ![]() MnCl2+ Cl2 ↑+ 2H2O;氧化性。
MnCl2+ Cl2 ↑+ 2H2O;氧化性。
(2)氯气与湿润的有色布条中的水先反应生成次氯酸,次氯酸具有漂白性而使有色布条褪色,因此装置②中的现象是红色褪去;故答案为:红色褪去。
(3)③中溶液由无色变为橙黄色,说明氯气置换出了单质溴,发生反应的离子方程式是2Br-+Cl2 = Br2 + 2Cl-;故答案为:2Br-+Cl2 = Br2 + 2Cl-。
(4)尾气氯气有毒,因此要用NaOH溶液处理尾气,反应生成氯化钠、次氯酸钠和水,用离子方程式解释④中NaOH溶液的作用Cl2 + 2OH-= Cl-+ ClO-+ H2O;故答案为:Cl2 + 2OH-= Cl-+ ClO-+ H2O。
(5)取一支试管,加入2 mL③中橙黄色溶液,③中溶液可能含有多余的Cl2 (HClO),Cl2 (HClO)氧化了I-离子生成I2,使得淀粉变蓝,因此不能得出Br2的氧化性强于I2 ;故答案为:否;有可能是溶液中的多余的Cl2 (HClO)氧化了I-离子生成I2。

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度(×10﹣3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①可以判断该分解反应已经达到化学平衡的是___(填字母).
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0℃时的分解平衡常数为___________ .
(2)已知:NH2COONH4+2H2O![]() NH4HCO3+NH3H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO﹣)随时间变化趋势如图所示.
NH4HCO3+NH3H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO﹣)随时间变化趋势如图所示.
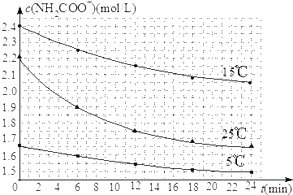
③计算25℃时,0~6min氨基甲酸铵水解反应的平均速率为__________ .
④根据图中信息,如何说明水解反应的平均速率随温度升高而增大:________________ .
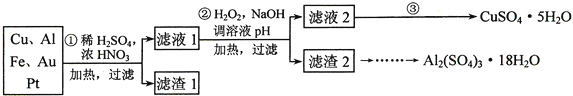
【题目】为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含![]() 、
、![]() 、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法: |
方法Ⅲ | 用肼 |
![]() 第
第![]() 步Cu与混酸反应的离子方程式为______
步Cu与混酸反应的离子方程式为______![]() 得到滤渣1的主要成分为______。
得到滤渣1的主要成分为______。
![]() 第
第![]() 步中加入
步中加入![]() 的作用是______,使用
的作用是______,使用![]() 的优点是______;调溶液pH的目的是______。
的优点是______;调溶液pH的目的是______。
![]() 简述第
简述第![]() 步由滤液2得到
步由滤液2得到![]() 的方法是______。
的方法是______。
![]() 由滤渣2制取
由滤渣2制取![]() ,设计了以下三种方案:
,设计了以下三种方案:
甲:滤渣![]() 酸浸液
酸浸液![]() Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O
乙:滤渣![]() 酸浸液
酸浸液![]() 滤液
滤液![]() Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O
丙:滤渣2![]() 滤液
滤液![]() 溶液
溶液![]() Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O
上述三种方案中,______方案不可行,原因是______;从原子利用率角度考虑,______方案更合理。
![]() 用滴定法测定
用滴定法测定![]() 含量.取ag试样配成100mL溶液,每次取
含量.取ag试样配成100mL溶液,每次取![]() ,消除干扰离子后,用c
,消除干扰离子后,用c![]()
![]() 标准溶液滴定至终点,平均消耗EDTA溶液b
标准溶液滴定至终点,平均消耗EDTA溶液b![]() 滴定反应如下:
滴定反应如下:![]() 写出计算
写出计算![]() 质量分数的表达式
质量分数的表达式![]() ______。
______。