题目内容
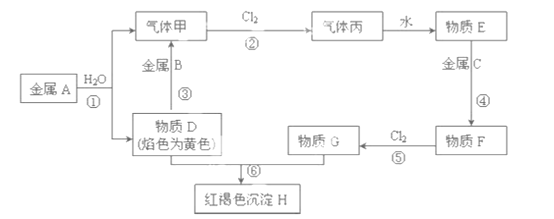
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去):
A. 反应①②③④⑤均属于氧化还原反应和离子反应
B. 反应⑤说明该条件下铝的氧化性强于锰
C. 生成等量的O2,反应③和④转移的电子数之比为1:2
D. 反应①中氧化剂与还原剂的物质的量之比为1:4
【答案】C
【解析】
A.①为二氧化锰与浓盐酸反应生成氯气、氯化锰、水,②为氯气与石灰乳反应生成氯化钙、次氯酸钙、水,③为过氧化氢分解生成水和氧气,④为氯酸钾分解生成氯化钾和氧气,⑤为铝和二氧化锰反应铝热反应生成Mn和氧化铝;
B.⑤为铝热反应,Al失去电子,为还原剂;
C.③中O元素的化合价由-1价升高为0,④中O元素的化合价有-2价升高为0;
D.①中Mn元素的化合价有+4价降低为+2价,HCl中Cl元素的化合价由-1价升高为0.
A、①为二氧化锰与浓盐酸反应生成氯气、氯化锰、水,②为氯气与石灰乳反应生成氯化钙、次氯酸钙、水,③为过氧化氢分解生成水和氧气,④为氯酸钾分解生成氯化钾和氧气,⑤为铝和二氧化锰反应铝热反应生成Mn和氧化铝,均存在元素的化合价变化,均属于氧化还原反应,③④⑤中没有离子参加反应,故A错误;
B、⑤为铝热反应,Al失去电子,为还原剂,Mn为还原产物,则还原性Al>Mn,故B错误;
C、③中O元素的化合价由-1价升高为0,④中O元素的化合价有-2价升高为0,则相同条件下生成等量的O2,反应③和④转移的电子数之比为1:2,故C正确;
D、反应①4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O中Mn元素的化合价由+4价降低为+2价,HCl中Cl元素的化合价由-1价升高为0,由电子守恒可知,氧化剂与还原剂的物质的量之比为1:2,故D错误;
MnCl2+Cl2↑+2H2O中Mn元素的化合价由+4价降低为+2价,HCl中Cl元素的化合价由-1价升高为0,由电子守恒可知,氧化剂与还原剂的物质的量之比为1:2,故D错误;
故选C。

【题目】下列除杂试剂的选择或除杂操作正确的是( )
选项 | 括号内为杂质 | 除杂试剂 | 除杂操作 |
A | CO2(SO2) | 饱和Na2CO3溶液 | 将气体通过足量的Na2CO3溶液 |
B | Na2O2(Na2O)固体 | O2 | 在纯氧气中加热 |
C | NO2(NO) | H2O | 将气体通入水中 |
D | NH3(H2O) | 浓硫酸 | 气体通入浓硫酸 |
A.AB.BC.CD.D
【题目】下列陈述I、Ⅱ正确并且有因果关系的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 干燥的氯气有强氧化性 | 氯水能使有色布条褪色 |
B | SO2是酸性氧化物 | SO2可使含有酚酞的NaOH溶液褪色 |
C | 盐酸和氨水能溶解Al(OH)3 | Al(OH)3是两性氢氧化物 |
D | 用淀粉-KI溶液鉴别FeCl2 | Fe2+有氧化性 |
A. A B. B C. C D. D