题目内容
(12分)已知:I2+2S2O===S4O+2I-。相关物质的溶度积常数见下表:
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入 ,(填化学式)调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)= 。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是 (用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是 。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用 作滴定指示剂,滴定终点的现象是 。
②CuCl2溶液与KI反应的离子方程式为 。
③该试样中CuCl2·2H2O的质量百分数为 。
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是 (用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是 。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用 作滴定指示剂,滴定终点的现象是 。
②CuCl2溶液与KI反应的离子方程式为 。
③该试样中CuCl2·2H2O的质量百分数为 。
(12分)(1) CuO或Cu(OH)2或 CuCO3或Cu2(OH)2CO3(1分)2.6×10-9 mol·L-1(2分)
(2)2CuCl2·2H2O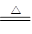 Cu(OH)2·CuCl2+2HCl+2H2O[主要产物写成Cu(OH)2、Cu(OH)Cl、CuO均可] (2分) 在干燥的HCl气流中加热脱水(1分)
Cu(OH)2·CuCl2+2HCl+2H2O[主要产物写成Cu(OH)2、Cu(OH)Cl、CuO均可] (2分) 在干燥的HCl气流中加热脱水(1分)
(3) ①淀粉溶液(1分) 蓝色褪去,放置一定时间后不复色(1分)
②2Cu2++4I-===2CuI↓+I2 (2分) ③95%(2分)
(2)2CuCl2·2H2O
 Cu(OH)2·CuCl2+2HCl+2H2O[主要产物写成Cu(OH)2、Cu(OH)Cl、CuO均可] (2分) 在干燥的HCl气流中加热脱水(1分)
Cu(OH)2·CuCl2+2HCl+2H2O[主要产物写成Cu(OH)2、Cu(OH)Cl、CuO均可] (2分) 在干燥的HCl气流中加热脱水(1分)(3) ①淀粉溶液(1分) 蓝色褪去,放置一定时间后不复色(1分)
②2Cu2++4I-===2CuI↓+I2 (2分) ③95%(2分)
试题分析:(1)由于在除杂的过程中不能引入新的杂质,所以要调节溶液的酸碱性,使氢氧化铁析出,而得到纯净的氯化铜晶体,则应该加入氧化铜或氢氧化铜。根据氢氧化铁的溶度积常数可知,当溶液的pH=4时,溶液中铁离子的浓度应该是
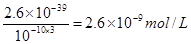 。
。(2)由于氯化铜在溶液中存在铜离子的水解平衡,而加热促进水解,且生成的氯化氢极易挥发,进一步促进水解,因此得不到氯化铜晶体,反应的化学方程式使是2CuCl2·2H2O
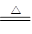 Cu(OH)2·CuCl2+2HCl+2H2O;因此由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水。
Cu(OH)2·CuCl2+2HCl+2H2O;因此由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水。(3)①由于碘离子被氧化生成了单质碘,而碘遇淀粉显蓝色,所以选择的指示剂是淀粉溶液。Na2S2O3将单质碘还原生成了碘离子,所以终点时的反应现象是蓝色褪去,放置一定时间后不复色。
②氯化铜能把碘化钾氧化生成单质碘,所以CuCl2溶液与KI反应的离子方程式是2Cu2++4I-===2CuI↓+I2。
③根据有关的反应方程式可知2CuCl2·2H2O~I2~2Na2S2O3,所以氯化铜晶体的物质的量是0.02L×0.1000mol/L=0.002mol,则试样中CuCl2·2H2O的质量百分数为
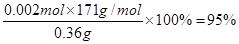 。
。点评:本题是高考中的常见题型,属于难度较大的试题,考查的知识点比较多。这类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。本题有利于培养学生的逻辑推理能力,以及分析问题、解决问题的能力。

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案
相关题目