题目内容
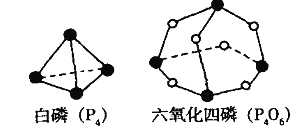
【题目】化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开) 1mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能: P-P 198 kJ.mol-1、P-O 360 kJ.mol-1、氧气分子内氧原子间的键能为498 kJ.mol-1 。则P4+3O2 =P4O6的反应热H为
A.+1638 kJ.mol-1 B.-1638 kJ.mol-1
C.-126 kJ.mol-1 D.+126 kJ.mol-1
【答案】B
【解析】
试题分析:化学键的键能:P-P 198 kJ.mol-1、P-O 360 kJ.mol-1、氧气分子内氧原子间的键能为498 kJ.mol-1,根据分子结构图,白磷燃烧放出的热量=生成物的键能-反应物的键能=12×360kJ-(6×198)kJ-(3×498)kJ=1638kJ,则P4+3O2 =P4O6的反应热H为-1638 kJ.mol-1,答案选B。

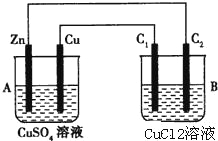
【题目】某小组同学在实验室里对Fe3+与I﹣的反应进行探究,实现Fe3+与Fe2+相互转化.
(1)甲同学首先进行了如下实验:
编号 | 操作 | 现象 |
Ⅰ | 先向2mL0.1molL﹣1FeCl2溶液中滴加KSCN溶液,再滴加新制氯水 | ___________________ ___________________ |
Ⅱ | 先向2mL0.1molL﹣1FeCl3溶液中滴加KSCN溶液,再滴加0.1molL﹣1KI溶液 | 滴加KSCN溶液后,溶液变成血红色;滴加0.1molL﹣1KI溶液后,血红色无明显变化 |
实验Ⅰ中发生反应的离子方程式为 , .
(2)实验II的现象与预测不同,为探究可能的原因,甲同学又进行了如下实验,
操作及现象如下:
编号 | 操作 | 现象 |
Ⅲ | 向2mL0.1molL﹣1KI溶液中滴加1mL 0.1molL﹣1FeCl3溶液,再滴加KSCN溶液 | 滴加FeCl3溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变成血红色 |
根据实验Ⅲ,该同学认为Fe3+有可能与I﹣发生氧化还原反应.请结合实验现象说明得出该结论的理由: .
(3)乙同学认为,还需要进一步设计实验才可证明根据实验Ⅲ中现象得出的结论.
请补全下表中的实验方案:
编号 | 操作 | 预期现象及结论 |
Ⅳ | 向2mL0.1molL﹣1KI溶液中滴加1mL 0.1molL﹣1 FeCl3,溶液变黄色,取该溶液于两支试管中, 试管①中滴加 , 试管②中滴加 . | 预期现象① , ② . 结论 . |
(4)上述实验结果表明,Fe3+有可能与I﹣发生氧化还原反应.进一步查阅资料知,参加反应的Fe3+和I﹣物质的量相同.该小组同学结合上述实验结论,分析了实验Ⅲ中加入KSCN后溶液变血红色的原因,认为Fe3+与I﹣反应的离子方程式应写为: .
【题目】铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺如下(部分操作和条件略):
Ⅰ.将铬铁矿和碳酸钠混合充分焙烧。
Ⅱ.焙烧后的固体加水浸取,分离得到溶液A和固体A。
Ⅲ.向溶液A中加入醋酸调pH约7~8,分离得到溶液B和固体B。
Ⅳ.再向溶液B中继续加醋酸酸化,使溶液pH小于5。
Ⅴ.向上述溶液中加入氯化钾,得到重铬酸钾晶体。
(1)Ⅰ中焙烧发生的反应如下,配平并填写空缺:
FeOCr2O3 + Na2CO3 + ![]() Na2CrO4 + Fe2O3 + CO2↑;
Na2CrO4 + Fe2O3 + CO2↑;
②Na2CO3+Al2O3=2NaAlO2+CO2↑。
(2)固体A中主要含有 (填写化学式)。
(3)已知重铬酸钾溶液中存在如下平衡:2CrO42-+2H+![]() Cr2O72-+H2O。Ⅳ中调节溶液pH<5时,其目的是 。
Cr2O72-+H2O。Ⅳ中调节溶液pH<5时,其目的是 。
(4)Ⅴ中发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,已知下表数据
物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度 (g/100g水) | 0℃ | 28[来 | 35.7 | 4.7 | 163 |
40℃ | 40.1 | 36.4 | 26.3 | 215 | |
80℃ | 51.3 | 38 | 73 | 376 | |
①该反应能发生的理由是 。
②获得K2Cr2O7晶体的操作有多步组成,依次是:加入KCl固体、 、 、过滤、洗涤、干燥得到晶体。
(5)Ⅲ中固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析固体B中氢氧化铝含量的方法是:称取n g样品,加入过量________(填写试剂名称)、溶解、过滤、再通入过量的CO2、…灼烧、冷却、称量,得干燥固体m g。计算样品中氢氧化铝的质量分数为______ (用含m、n的代数式表示)。