��Ŀ����
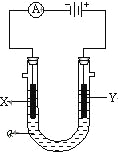
����Ŀ��ijС��ͬѧ��ʵ�������Fe3+��I���ķ�Ӧ����̽����ʵ��Fe3+��Fe2+�ת����
��1����ͬѧ���Ƚ���������ʵ�飺
��� | ���� | ���� |
�� | ����2mL0.1molL��1FeCl2��Һ�еμ�KSCN��Һ���ٵμ�������ˮ | ___________________ ___________________ |
�� | ����2mL0.1molL��1FeCl3��Һ�еμ�KSCN��Һ���ٵμ�0.1molL��1KI��Һ | �μ�KSCN��Һ����Һ���Ѫ��ɫ���μ�0.1molL��1KI��Һ��Ѫ��ɫ�����Ա仯 |
ʵ�����з�����Ӧ�����ӷ���ʽΪ �� ��
��2��ʵ��II��������Ԥ�ⲻͬ��Ϊ̽�����ܵ�ԭ��ͬѧ�ֽ���������ʵ�飬
�������������£�
��� | ���� | ���� |
�� | ��2mL0.1molL��1KI��Һ�еμ�1mL 0.1molL��1FeCl3��Һ���ٵμ�KSCN��Һ | �μ�FeCl3��Һ����Һ��ɻ�ɫ���μ�KSCN��Һ����Һ���Ѫ��ɫ |
����ʵ��������ͬѧ��ΪFe3+�п�����I������������ԭ��Ӧ������ʵ������˵���ó��ý��۵����ɣ� ��
��3����ͬѧ��Ϊ������Ҫ��һ�����ʵ��ſ�֤������ʵ����������ó��Ľ��ۣ�
�벹ȫ�±��е�ʵ�鷽����
��� | ���� | Ԥ�������� |
�� | ��2mL0.1molL��1KI��Һ�еμ�1mL 0.1molL��1 FeCl3����Һ���ɫ��ȡ����Һ����֧�Թ��У� �Թ����еμ� �� �Թ����еμ� �� | Ԥ�������� �� �� �� ���� �� |
��4������ʵ����������Fe3+�п�����I������������ԭ��Ӧ����һ����������֪���μӷ�Ӧ��Fe3+��I�����ʵ�����ͬ����С��ͬѧ�������ʵ����ۣ�������ʵ�����м���KSCN����Һ��Ѫ��ɫ��ԭ����ΪFe3+��I����Ӧ�����ӷ���ʽӦдΪ�� ��
���𰸡���1��
��� | ���� | ���� |
�� | �μ�KSCN����Һ�����Ա仯 �� ������ˮ����Һ���Ѫ��ɫ | |
�� |
2Fe2++Cl2�T2Fe3++2Cl����Fe3++3SCN��=Fe��SCN��3��
��2����Һ��ɻ�ɫ���Ʋ�������I2��
��3��
��� | ���� | Ԥ�������� |
�� | �μӵ�����Һ����CCl4�� �μ����軯����Һ | Ԥ��������Һ���� ������Һ�ֲ㣬�²���ҺΪ�Ϻ�ɫ�� ����������ɫ���� ���ۣ�Fe3+����I������������ԭ��Ӧ������I2��Fe2+ |
��4��2Fe3++2I��![]() 2Fe2++I2��
2Fe2++I2��
��������
�����������1�����������Ӻ����軯����Һ����Ӧ���������Ȼ�������Һ�еμ����軯����Һ����Һ���ʺ�ɫ���ٵμ���ˮ���������������������������ӣ������Ӻ����軯����Һ��Ӧ��������������Һ��Ѫ��ɫ������ʵ��I������Ϊ�μ�KSCN����Һ�����Ա仯��������ˮ����Һ��ɺ�ɫ�����Ȼ�������������Ӧ�����Ȼ�������Ӧ���ӷ���ʽΪ��2Fe2+ + Cl2 �T 2Fe3+ + 2Cl-��Fe3+ + 3SCN�� = Fe��SCN��3����2����ˮ��Һ�ʻ�ɫ��������Һ��ɻ�ɫ���Ʋ�������I2����3����������Ӻ������ӷ���������ԭ��Ӧ���ɵⵥ�ʺ��������ӣ��������Ӻ����軯����Һ��Ӧ������ɫ�������ⵥ����������Һ����ɫ�����������Ȼ�̼����Һ����ɫ���������Ҫ����ⵥ�ʺ��������ӣ��������ٵμӵ�����Һ����CCl4�������軯����Һ�����飬��Ӧ��������Һ����������Һ�ֲ㣬�²���ҺΪ��ɫ����������ɫ�����������ۣ�Fe3+����I-����������ԭ��Ӧ������I2����Fe2+������4��Fe3+��I-����������ԭ��Ӧ���Ҳμӷ�Ӧ��Fe3+��I-�����ʵ�����ͬ�����Ը÷�Ӧ�����ӷ���ʽΪ��2Fe3++2I-2Fe2++I2��

 Ӣ�żƻ���ĩ����ϵ�д�
Ӣ�żƻ���ĩ����ϵ�д�