题目内容
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为: 2KClO3 +4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况:(单线桥法表示)________________________。
(2)氧化剂与还原剂的物质的量之比是 ___________________
(3)若产生标况下22.4 L Cl2,则转移的电子的物质的量为________mol。
(4)实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸中HCl的物质的量浓度 mol·L-1。
(5)ClO2对污水中Fe2+、Mn2+、S2-和CN- 等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN - 氧化,只生成两种气体,其离子反应方程式为为 ,处理100 m3这种污水,至少需要ClO2 _______mol。
【答案】(1)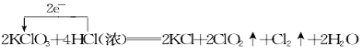 ;
;
(2)1:1;(3)2;(4)11.9;
(5)2ClO2 + 2CN- = N2 + 2CO2 + 2Cl-,50a/13 (或3.85a)。
【解析】
试题分析:(1)根据氧化还原反应中的价态归中规律判断元素化合价只靠拢不交叉,所以氯酸钾中的氯元素化合价由+5降到二氧化氯中的+4价,盐酸中的氯元素由-1价升到0价,该反应中电子转移的情况为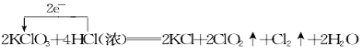 。
。
(2)2mol氯酸钾中的氯元素化合价全部由+5降到二氧化氯中的+4价,作氧化剂,4molHCl中的氯元素的化合价只有2mol由-1价升到0价,作还原剂,氧化剂与还原剂的物质的量之比是1:1。
(3)标况下22.4 L Cl2的物质的量为1mol,根据(1)知转移的电子的物质的量为2mol。
(4)根据公式c=![]() 计算质量分数为36.5%,密度为1.19 g·cm-3的浓盐酸中HCl的物质的量浓度为(1000×1.19×36.5%)÷36.5=11.9mol·L-1。
计算质量分数为36.5%,密度为1.19 g·cm-3的浓盐酸中HCl的物质的量浓度为(1000×1.19×36.5%)÷36.5=11.9mol·L-1。
(5)根据题意知ClO2将CN - 氧化生成二氧化碳和氮气,本身被还原为Cl-,利用化合价升降法配平,该反应的离子方程式为2ClO2 + 2CN- = N2 + 2CO2 + 2Cl- ,废水中CN- 的浓度为a mg/L,即为ag/m3,100 m3污水含CN-的质量为100ag,物质的量为100ag÷26g/mol=50a/13mol,根据反应方程式知至少需要ClO2 50a/13mol 。

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案【题目】800 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O维持恒温,发生反应CO(g)+H2O(g)![]() H2(g)+CO2(g),反应过程中测定的部分数据见下表:
H2(g)+CO2(g),反应过程中测定的部分数据见下表:
反应时间/min | 0 | 2 | 4 | 6 |
n(CO)/mol | 1.20 | 0.90 | 0.80 | |
n(H2O)/mol | 0.60 | 0.20 |
(1)反应在2 min内的平均速率为v(H2O)=________。
(2)800 ℃时,化学平衡常数K的值为________。
(3)保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率________(填“增大”、“减小”或“不变”)。
(4)在恒温恒压密闭容器中通入CO和H2O各1 mol发生该反应,当反应达到平衡后,维持温度与压强不变,t1时再通入各1 mol的CO和H2O的混合气体,请在下图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图。