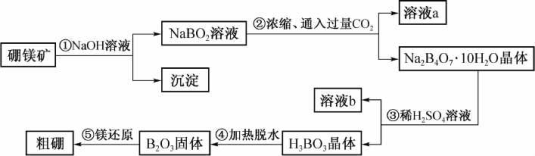
题目内容
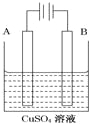
【题目】按如图所示装置进行实验,并回答下列问题:

(1)判断装置的名称:A池为 ,B池为 .
(2)锌棒上发生 反应,电极反应式为 ;铜棒上的现象是 ,电极反应式为 ;石墨棒C1上发生的电极反应式为 .
【答案】(1)原电池;电解池;
(2)氧化;Zn﹣2e﹣=Zn2+;有红色物质生成;Cu2++2e﹣=Cu;2Cl﹣﹣2e﹣=Cl2↑.
【解析】
试题分析:(1)该装置中A能自发的进行氧化还原反应为原电池,B为电解池;
(2)锌、铜原电池中,锌易失电子作负极,铜作正极,B中连接铜的电极为阳极,连接锌的电极为阴,电解池中阳极上氯离子放电,阴极上铜离子放电,据此回答判断.
解:(1)A中金属锌和硫酸铜之间能自发的进行氧化还原反应,能将化学能转化为电能,所以为原电池,B有外接电源,属于电解池,
故答案为:原电池;电解池;
(2)A中锌电极上失电子发生氧化反应生成锌离子进入溶液,Zn﹣2e﹣=Zn2+,铜电极上铜离子得电子生成铜单质,Cu2++2e﹣=Cu,铜棒上有红色物质生成,石墨棒C1为阳极,阳极上是氯离子失电子析出氯气的过程,2Cl﹣﹣2e﹣=Cl2↑,
故答案为:氧化;Zn﹣2e﹣=Zn2+;有红色物质生成;Cu2++2e﹣=Cu;2Cl﹣﹣2e﹣=Cl2↑.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】800 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O维持恒温,发生反应CO(g)+H2O(g)![]() H2(g)+CO2(g),反应过程中测定的部分数据见下表:
H2(g)+CO2(g),反应过程中测定的部分数据见下表:
反应时间/min | 0 | 2 | 4 | 6 |
n(CO)/mol | 1.20 | 0.90 | 0.80 | |
n(H2O)/mol | 0.60 | 0.20 |
(1)反应在2 min内的平均速率为v(H2O)=________。
(2)800 ℃时,化学平衡常数K的值为________。
(3)保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率________(填“增大”、“减小”或“不变”)。
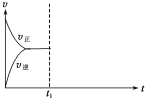
(4)在恒温恒压密闭容器中通入CO和H2O各1 mol发生该反应,当反应达到平衡后,维持温度与压强不变,t1时再通入各1 mol的CO和H2O的混合气体,请在下图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图。