题目内容
【题目】【物质结构与性质】磷化硼(BP)是一种受关注的耐磨涂层材料,可作为钛等金属表面的保护薄膜。
(1)三溴化硼和三溴化磷混合物在高温条件下与H2反应可以制得BP。
①上述反应的化学方程式为________________________;
②磷原子中存在_____种不同能量的电子,电子占据的最高能层符号为_______。
③常温下,三溴化磷是淡黄色发烟液体,可溶于丙酮、四氯化碳中,该物质属于______晶体(填晶体类型)。
(2)已知磷酸是中强酸,硼酸是弱酸;pKa= -lgKa。
①有机酸的酸性强弱受邻近碳上取代原子的影响,如酸性:BrCH2COOH >CH3COOH。据此推测,pKa:AtCH2COOH____ClCH2COOH(填“>”、“<”、“=”)
②磷酸是三元酸,写出两个与PO43-具有相同空间构型和键合形式的分子或离子_________________。
③硼酸是一元酸,它在水中表现出来的弱酸性,并不是自身电离出氢离子所致,而是水分子与B(OH)3结合,生成一个酸根离子,该阴离子的结构式为:_________(若存在配位键,请用箭头标出)。
(3)高温陶瓷材料Si3N4的成键方式如图1所示,结构中N—Si—N的键角比Si—N—Si的键角大,其原因是_____________________________________。
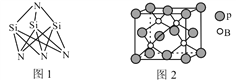
(4)磷化硼的晶体结构如图2所示。晶胞中P原子的堆积方式为________(填“简单立方”、“体心立方”或“面心立方最密”)堆积。若该晶体中最邻近的两个P原子之间的距离为a nm,则晶体密度为__________g·cm-3(只需列出计算式)。
【答案】 BBr3 + PBr3 + 3H2 ![]() BP + 6HBr 5 M 分子 > SO42-、ClO4- 等合理答案
BP + 6HBr 5 M 分子 > SO42-、ClO4- 等合理答案 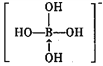 N、Si原子均采取sp3杂化,一个Si原子与4个N原子成键,N—Si—N的键角为109.5;而一个N原子与3个Si原子成键,N上一对孤对电子对成排斥力大于成键电子,压缩了Si—N—Si的键角 面心立方最密
N、Si原子均采取sp3杂化,一个Si原子与4个N原子成键,N—Si—N的键角为109.5;而一个N原子与3个Si原子成键,N上一对孤对电子对成排斥力大于成键电子,压缩了Si—N—Si的键角 面心立方最密 ![]()
【解析】(1)①根据反应条件和反应物、生成物书写方程式为BBr3+PBr3+3H2![]() BP+6HBr,故答案为:BBr3+PBr3+3H2
BP+6HBr,故答案为:BBr3+PBr3+3H2![]() BP+6HBr;
BP+6HBr;
②P原子核外有1s、2s、2p、3s、3p五种能级,一种能级有一种能量的电子;电子占据的最高能层符号为M,故答案为:5;M;
③分子晶体熔沸点较低,常温下,三溴化磷是淡黄色发烟液体,可溶于丙酮、四氯化碳中,该晶体熔沸点较低,说明为分子晶体,故答案为:分子;
(2)①酸的酸性越强,该酸溶液的pKa越小,酸性:BrCH2COOH>CH3COOH,据此推测取代原子得电子能力越强酸性越强,可知酸性AtCH2COOH<ClCH2COOH,则pKa:AtCH2COOH>ClCH2COOH,故答案为:>;
②等电子体的结构和键合形式相同,则与磷酸根离子互为等电子体的微粒为SO42-、ClO4-等合理答案,故答案为:SO42-、ClO4-等合理答案;
③硼酸电离方程式为B(OH)3+H20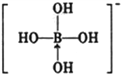 +H+,据此书写其电离出阴离子结构式为
+H+,据此书写其电离出阴离子结构式为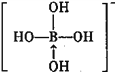 ,故答案为:
,故答案为: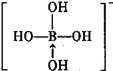 ;
;
(3)N、Si原子均采取sp3杂化,一个Si原子与4个N原子成键,N-Si-N的键角为109.5°,而一个N原子与3个Si原子成键,N上还有一对孤对电子,孤电子对与成键电子对间的排斥力大于成键电子对之间的排斥力,所以Si-N-Si的键角更小,
故答案为:N、Si原子均采取sp3杂化,一个Si原子与4个N原子成键,N—Si—N的键角为109.5;而一个N原子与3个Si原子成键,N上一对孤对电子对成排斥力大于成键电子,压缩了Si—N—Si的键角。
(4)根据图知,该晶胞是面心立方最密堆积,若该晶体中最邻近的两个P原子之间的距离为anm,晶胞的棱长= ![]() anm,该晶胞中P原子个数
anm,该晶胞中P原子个数![]() B原子个数为4,晶胞密度
B原子个数为4,晶胞密度 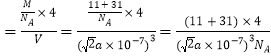 故答案为:面心立方最密;
故答案为:面心立方最密;![]()

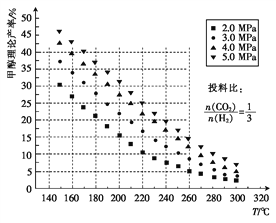
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
(1)已知上述反应中相关的化学键键能数据如下:
化学键 | C-H | C=O | H-H | C≡O(CO) |
键能/kJ·mol-1 | 413 | 745 | 436 | 1075 |
则该反应的△H=______kJ·mol-1。
(2)为了加快该反应的速率,可以进行的措施是(_____)。
A.恒温恒压下,按原比例充入CH4、CO2
B.恒温下,缩小容器体积
C.增大反应物与催化剂的接触面积
D.降低温度
(3)恒温下,向2L体积恒定的容器中充入一定量的CO2、CH4,使其在催化剂作用下进行反应,经tmin后,测得CO有amol,则v(CO2)=______。下列各项能说明该反应达到平衡的是(______)。
A.容器内气体密度保持一定 B.容器内CO2、CH4的浓度之比为1∶1
C.该反应的正反应速率保持一定 D.容器内气体压强保持一定
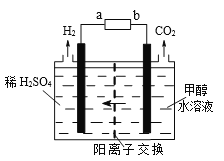
(4)用甲烷作燃料的碱性燃料电池中,电极材料为多孔惰性金属电极,则负极的电极反应式为_______________。