题目内容
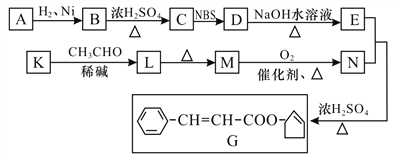
【题目】【有机化学基础】香料G的一种合成工艺如下图所示:
核磁共振氢谱显示A有两种峰,且峰面积之比为1∶1,且不含C=C。
已知:CH3CH2CH==CH2![]() CH3CHBrCH==CH2
CH3CHBrCH==CH2
CH3CHO+CH3CHO![]() CH3CHOHCH2CHO
CH3CHOHCH2CHO
CH3CHOHCH2CHO![]() CH3CH==CHCHO+H2O
CH3CH==CHCHO+H2O
请回答:
(1)A的结简式为_______________,G中除苯环外官能团的名称为___________________。
(2)检验M已完全转化为N的实验操作和现象是:_______________,则M已完全转化为N。
(3)有学生建议,将M→N的转化用KMnO4(H+)代替O2,老师认为不合理,原因是_____________。
(4)K→L的化学方程式为___________________________,反应类型为______________。
(5)F是M的同系物,比M多一个碳原子。满足下列条件的F的同分异构体有________种(不考虑立体异构):①能发生银镜反应,②能与溴的四氯化碳溶液加成,③苯环上有2个取代基;这些同分异构体中,其中不含甲基、碳原子在苯环两侧对称分布的同分异构体的结构简式为__________________。
(6)以丙烯和NBS试剂为原料制备甘油(丙三醇),请设计合成路线(其他无机原料任选):__________【请用以下方式表示:A![]() B…
B…![]() 目标产物】。
目标产物】。
【答案】 ![]() 碳碳双键、酯基 取少量转化物于试管中,滴加浓NaOH至溶液呈碱性,再加新制的Cu(OH)2加热,若没有砖红色沉淀产生则M已转化完全 KMnO4(H+)在氧化醛基的同时,还会氧化碳碳双键
碳碳双键、酯基 取少量转化物于试管中,滴加浓NaOH至溶液呈碱性,再加新制的Cu(OH)2加热,若没有砖红色沉淀产生则M已转化完全 KMnO4(H+)在氧化醛基的同时,还会氧化碳碳双键 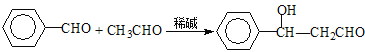 加成反应 18
加成反应 18 ![]() CH2==CH—CH3
CH2==CH—CH3![]() CH2==CH—CH2—Br
CH2==CH—CH2—Br![]()
![]()
![]()
![]()
【解析】试题分析:根据流程图和题给信息可知,E、N在浓硫酸的催化下发生酯化反应生成酯G,将G的酯基断裂,则E为3-羟基环己烯、N为苯丙烯酸,D在NaOH溶液中加热生成E,则D为3-溴己烯,根据信息1可知C为己烯,B在浓硫酸加热的条件下生成C,则B为环己醇,则A为环己酮。根据已知2,3可知K为苯甲醛,L为![]() ,M为苯丙烯醛,M在氧气、催化剂的条件下加热生成N(苯丙烯酸)。
,M为苯丙烯醛,M在氧气、催化剂的条件下加热生成N(苯丙烯酸)。
(1)根据上述分析,A为环己酮,核磁共振氢谱显示A有两种峰,其强度之比为1: 1,所以其结构简式为![]() ,G中官能团的名称为碳碳双键、酯基;
,G中官能团的名称为碳碳双键、酯基;
(2)检验M已完全转化为N,实际上是检验M中无醛基,实验操作是取少量转化物于试管中,滴加浓NaOH至溶液呈碱性,再加新制的Cu(OH)2加热,若没有砖红色沉淀产生则M已转化完全。
(3)KMnO4(H+)溶液具有强氧化性,能将醛基和碳碳双键氧化,所以不能将M→ N的转化用KMnO4(H+)代替O2,原因是KMnO4(H+)在氧化醛基的同时,还可以氧化碳碳双键。
(4)K→L的化学反应为: ,根据反应特点,该反应是加成反应。
,根据反应特点,该反应是加成反应。
(5)F是M(苯丙烯醛)的同系物,比M多一个碳原子,说明有10个碳原子的芳香族化合物,①能发生银镜反应,说明有醛基,②能与溴的四氯化碳溶液加成,说明有碳碳双键,③苯环上有2个取代基,所以同分异构体的两个取代基分别是一个取代基为甲基,另一个取代基有两种连法;一个是乙烯基,另一个是乙醛基;一个是取代基为醛基,另一个丙烯基3种连法,取代基的异构共有6种,两种取代基还有邻、间、对三种位置关系,共18种同分异构。其中不含甲基、碳原子在苯环两侧对称分布的同分异构体的结构简式为![]() 。
。
(6)以丙烯和NBS试剂为原料制各甘油(丙三醇),合成路线为:CH2==CH—CH3![]() CH2==CH—CH2—Br
CH2==CH—CH2—Br![]()
![]()
![]()
![]() 。
。

 考前必练系列答案
考前必练系列答案【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D
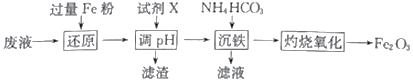
【题目】某工厂酸性废液中含有Fe3+、Al3+、Fe2+、SO42-,以该废液为原料制备Fe2O3的工艺流程如下(部分操作和条件略):
已知:①NH4HCO3在热水中会分解。
②常温下,溶液中不同金属离子生成氢氧化物沉淀时的pH见下表:
金属离子(0.1mol·L-l) | Fe3+ | Fe2+ | Al3+ |
开始沉淀时的pH | 2.4 | 7.6 | 3.4 |
完全沉淀时的pH | 3.7 | 9.6 | 4.8 |
回答下列问题:
(1)写出“还原”步骤中反应的离子方程式:_________________________________。
(2)试剂X可选用_________(任写一种,填化学式),“滤渣”的主要成分是_________________。
(3)加入碳酸氢铵后过滤,发现滤液仍然浑浊,可能的原因是_________________________,用90℃热水洗涤FeCO3沉淀的目的是______________________________________。
(4)若在实验室中灼烧FeCO3应在_____________(填仪器名称)中进行,“灼烧氧化”发生的化学方程式为__________________________________。
(5)若工业上灼烧氧化174.0吨FeCO3得到117.6吨产品,则该产品中Fe2O3的纯度为___________ (设产品中杂质只有FeO,保留一位小数)。