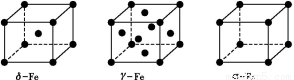
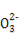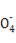题目内容
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1 mol/L的100 mL FeCl3溶液中,含有的离子数为0.04NA
B.标准状况下,将m1克锌加入m2克20%的盐酸中放出n L H2,则转移电子数为nNA/11.2
C.9 g D2O中含有的电子数为5NA
D.120 g由NaHSO4和KHSO3组成的混合物中共含有3NA的阴阳离子
B
【解析】Fe3+水解:Fe3++3H2O Fe(OH)3(胶体)+3H+,故含有的离子数大于0.04NA,A项错误;生成标准状况下n L H2需要的电子数为
Fe(OH)3(胶体)+3H+,故含有的离子数大于0.04NA,A项错误;生成标准状况下n L H2需要的电子数为 ×2×NA=
×2×NA=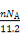 ,B项正确;9 g D2O即0.45 mol,其含有的电子数为4.5NA,C项错误;120 g由NaHSO4和KHSO3组成的混合物中,含1 mol Na+和K+,1 mol HS
,B项正确;9 g D2O即0.45 mol,其含有的电子数为4.5NA,C项错误;120 g由NaHSO4和KHSO3组成的混合物中,含1 mol Na+和K+,1 mol HS 和HS
和HS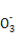 ,D项错误。
,D项错误。

练习册系列答案
相关题目