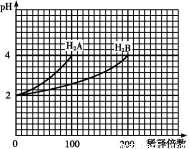
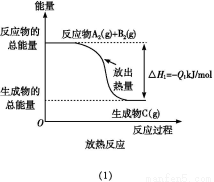
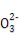题目内容
25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(C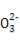 )均增大
)均增大
C
【解析】本题主要考查盐类的水解和弱电解质的电离。NaHCO3和Na2CO3溶液中都存在盐的水解平衡和水的电离平衡,A正确;HC 水解和电离后与C
水解和电离后与C 水解后的粒子种类一样,此时两溶液中均存在:HC
水解后的粒子种类一样,此时两溶液中均存在:HC 、C
、C 、H2CO3、OH-、Na+、H+、H2O,B正确;因为C
、H2CO3、OH-、Na+、H+、H2O,B正确;因为C 水解程度大于HC
水解程度大于HC ,所以Na2CO3溶液碱性更强,C错误;加入NaOH固体,前者因OH-与HC
,所以Na2CO3溶液碱性更强,C错误;加入NaOH固体,前者因OH-与HC 反应而使c(C
反应而使c(C )增大,后者因OH-抑制C
)增大,后者因OH-抑制C 的水解而使c(C
的水解而使c(C )增大,D正确。
)增大,D正确。

练习册系列答案
相关题目
今有室温下四种溶液,有关叙述不正确的是( )
| ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(N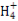 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D.Va L ④与Vb L ②溶液混合,若混合后溶液pH=4,则Va∶Vb=11∶9