题目内容
【题目】为验证氧化性Cl2>Fe3+> SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
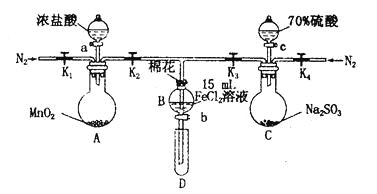
实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭K2。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的离子。
V.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程I的目的是____。
(2)检验B中溶液是否还有Fe2+的方法之一是:取少量B中溶液于试管中,滴加几滴含有+3价铁元素的配合物溶液,会产生蓝色沉淀.写出该反应的离子方程式____ 。
(3)若向第III步B中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式____。
(4)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的化学方程式为________。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定不能够证明氧化性Cl2>Fe3+>SO2的是____(填“甲”、“乙”或“丙”)。
过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中 含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
(6)将B中的FeCl2溶液换成100 mLFeBr2溶液并向其中通入1.12 LCl2(标准状况下),若溶液中有1/2的Br一被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为____ mol/L。
【答案】(1)排出装置中的空气,防止干扰;
(2)3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;
(3)2Fe3++H2S═2Fe2++2H++S↓;
(4)2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4;
(5)甲;
(6)0.5
【解析】试题分析:(1)打开K1~K4,关闭K5、K6,通入一段时间N2,目的是排出装置中的氧气,故答案为:排出装置中的空气,防止干扰;
(2)检验B中溶液是否还有Fe2+的方法,用二价铁与+3价铁元素的配合物溶液反应生成蓝色沉淀的离子方程式为:3Fe2++2(Fe(CN)6)3-=Fe3(Fe(CN)6)2↓,故答案为:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;
(3)三价铁离子与硫化氢反应,生成硫沉淀、二价铁、水,离子方程式为:2Fe3++H2S═2Fe2++2H++S↓,故答案为:2Fe3++H2S═2Fe2++2H++S↓;
(4)SO2具有还原性,酸性高锰酸钾溶液具有强的氧化性,二者混合后可以发生氧化还原反应:2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4,使高锰酸钾褪色,故答案为:2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4;
(5)乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫,丙中第一次有Fe3+,无Fe2+,则氯气的氧化性大于铁离子,第二次有亚铁离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫,故答案为:甲;
(6)设FeBr2的物质的量浓度为c,由电子守恒可知, ![]() ×2×1=c×0.1L×(3-2)+c×0.1L×2×
×2×1=c×0.1L×(3-2)+c×0.1L×2×![]() ×(1-0),解得c=0.5mol/L,故答案为:0.5
×(1-0),解得c=0.5mol/L,故答案为:0.5




