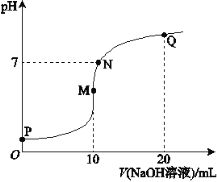
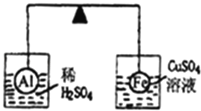
题目内容
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:
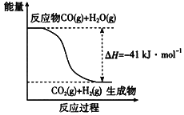
反应的热化学方程式为____________________________________________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0kJ·mol-1,N-H键的键能是391.55kJ·mol-1,则![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g) ΔH=______________。
NH3(g) ΔH=______________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:①C(s,石墨)+O2(g)![]() CO2(g) ΔH1=-393.5kJ·mol-1
CO2(g) ΔH1=-393.5kJ·mol-1
②2H2(g)+O2(g)![]() 2H2O(l) ΔH2=-571.6kJ·mol-1
2H2O(l) ΔH2=-571.6kJ·mol-1
③2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1
4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1
298K时反应2C(s,石墨)+H2(g)![]() C2H2(g)的焓变:ΔH=_______________。
C2H2(g)的焓变:ΔH=_______________。
(4)已知:铝热反应是放热反应,又知,常温下:
4Al(s)+3O2(g)![]() 2Al2O3(s) ΔH1
2Al2O3(s) ΔH1
4Fe(s)+3O2(g)![]() 2Fe2O3(s) ΔH2
2Fe2O3(s) ΔH2
下面关于ΔH1、ΔH2的比较正确的是________
A.ΔH1>ΔH2 B.ΔH1<ΔH2 C.ΔH1=ΔH2 D.无法计算
【答案】CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41kJ·mol-1-46.2kJ·mol-1226.7kJ·mol-1 B
CO2(g)+H2(g) ΔH=-41kJ·mol-1-46.2kJ·mol-1226.7kJ·mol-1 B
【解析】
(1)依据图象分析反应物能量高于生成物能量,反应是放热反应,书写热化学方程式时,注意标注物质聚集状态和对应焓变的大小;(2)△H=反应物的键能-生成物的键能;(3)将已知三个热化学方程式依次编号为①②③,由盖斯定律可知目标热化学方程式等于①×2+②×![]() -③×
-③×![]() ;(4)将已知两个热化学方程式依次编号为①②,由盖斯定律,①-②可得:4Al(s)+2Fe2O3═2Al2O3(s)+4Fe(s) △H=△H1-△H2。
;(4)将已知两个热化学方程式依次编号为①②,由盖斯定律,①-②可得:4Al(s)+2Fe2O3═2Al2O3(s)+4Fe(s) △H=△H1-△H2。
(1)由图象可知,反应物能量高于生成物能量,该反应是放热反应,1molCO完全反应放出的热量41kJ,热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ/mol。(2)据题意,N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0kJ·mol-1,N-H键的键能是391.55kJ·mol-1,由△H=反应物的键能-生成物的键能可知,0.5mol氮气和1.5mol氢气反应生成1mol氨气时△H=(3×391.55kJ·mol-1)—(0.5×948.9kJ·mol-1+1.5×436.0kJ·mol-1)=46.2 kJ·mol-1。(3)目标反应为2C(s,石墨)+H2(g)= C2H2(g),将已知三个热化学方程式依次编号为①②③,由盖斯定律可知目标热化学方程式等于①×2+②×![]() -③×
-③×![]() ,所以反应焓变△H=2×(-393.5 kJ·mol-1)+(-571.6 kJ·mol-1)×
,所以反应焓变△H=2×(-393.5 kJ·mol-1)+(-571.6 kJ·mol-1)×![]() -(-2599 kJ·mol-1)×
-(-2599 kJ·mol-1)×![]() =+226.7 kJ·mol-1。(4)将已知两个热化学方程式依次编号为①②,由盖斯定律,①-②可得:4Al(s)+2Fe2O3═2Al2O3(s)+4Fe(s)△H1-△H2,铝热反应为放热反应,即△H1-△H2<0,所以△H1<△H2,故选B。
=+226.7 kJ·mol-1。(4)将已知两个热化学方程式依次编号为①②,由盖斯定律,①-②可得:4Al(s)+2Fe2O3═2Al2O3(s)+4Fe(s)△H1-△H2,铝热反应为放热反应,即△H1-△H2<0,所以△H1<△H2,故选B。

【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收,其中Y是单质。
SO 2(g) + 2CO(g)![]() 2X(g)+Y(l)
2X(g)+Y(l)
为了测定在某种催化剂作用下的反应速率,在某温度下用超灵敏气体传感器测得不同时间的SO2和CO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(SO2)/mol·L-1 | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 |
c(CO)/mol·L-1 | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 |
下列说法不正确的是
A. X的化学式为CO2
B. 前1s内v(X)=" 1.00" mol·L-1·s-1
C. 该回收原理运用了SO2的还原性
D. 该温度下,此反应的平衡常数的数值是3.33×1036