题目内容
【题目】25℃时,向10 mL 0.1 mol·L-1 NH4HSO4溶液中逐滴滴入0.1 mol·L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如右图所示:
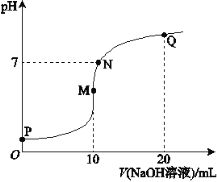
(1)用电离方程式表示P点pH<7的原因是________。
(2)M、Q两点中,水的电离程度较大的是________点。
(3)下列关系中,正确的是________。
a.M点c(Na+)>c(NH4+)
b.N点c(NH4+)+c(Na+)=2c(SO42-)
c.Q点c(NH4+)+c(NH3·H2O)=c(Na+)
【答案】
(1)NH4HSO4=NH4++H++SO42-或HSO4-=H++SO42-
(2)M(3)ab;
【解析】
试题分析:(1)NH4HSO4溶液中存在NH4HSO4 = NH4+ + H+ + SO42-,因此P点pH<7,故答案为:NH4HSO4 = NH4+ + H+ + SO42-;
(2)M点,溶质为硫酸钠和(NH4)2SO4的混合物,(NH4)2SO4水解,促进水的电离,Q点溶质为一水合氨、硫酸钠,一水合氨的电离抑制水的电离,水的电离程度较大的是M点,故答案为:M;
(3)a. M点溶质为硫酸钠和(NH4)2SO4的混合物,铵根离子水解,c(Na+) > c(NH4+),正确;b. N点溶液呈中性,根据电荷守恒,c(NH4+) + c(Na+) = 2c(SO42-),正确;c. Q点溶质为等物质的量一水合氨、硫酸钠,根据物料守恒,2c(NH4+) +2 c(NH3·H2O) = c(Na+),错误;故选ab。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案【题目】如下图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )

选项 | 实验现象 | 解 释 |
A | 浓盐酸附近产生白烟 | NH3与浓盐酸反应产生了微小的NH4Cl晶体 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
D | 湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
A. A B. B C. C D. D



