题目内容
在硫酸铝、硫酸钾和明矾的混合溶液中,如果SO42—的浓度为0.2 mol·L-1,当加入等体积0.2 mol·L-1KOH溶液时,生成的沉淀恰好完全溶解,则反应后混合溶液中K+的浓度约是(忽略溶液中少量的H+和OH-)( )。
| A.0.125 mol·L-1 | B.0.225 mol·L-1 | C.0.250 mol·L-1 | D.0.450 mol·L-1 |
B
解析

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
设阿伏加德罗常数的值为,则下列说法正确的是 ( )
A.标准状况下,22.4 L乙烯含有的共用电子对数为2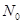 |
B.常温下,含有1 mol NaHSO4溶液中的阳离子数为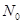 |
C.通常状况下,1 mol NO和0.5 molO2在密闭容器中混合,生成NO2分子数为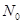 |
D.制取漂白粉时,标准状况下22.4 LCl2参加反应,转移电子数为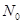 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.1mol氯气参加氧化还原反应,转移的电子数一定为2NA |
| B.25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.02NA |
| C.12 g石墨和C60的混合物中质子总数一定为6NA个 |
| D.常温常压下,22.4L乙烯中C?H键数为4NA |
某地酸雨经检验除含H+外[c(OH-)可以忽视]还有Na+、Cl-、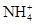 、
、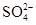 ,其浓度依次为:c(Na+)=2.3×10-5mol/L,c(Cl-)=3.5×10-5mol/L,
,其浓度依次为:c(Na+)=2.3×10-5mol/L,c(Cl-)=3.5×10-5mol/L,
c(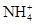 )=2.3×10-5mol/L,c(
)=2.3×10-5mol/L,c(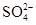 )=1.05×10-5mol/L。则该地酸雨的pH为( )
)=1.05×10-5mol/L。则该地酸雨的pH为( )
| A.3 | B.4 | C.5 | D.6 |
设NA代表阿伏加德罗常数的值,下列说法正确的是( )。
| A.1 mol甲基(—CH3)中含有的电子数为7NA |
| B.25 ℃时,pH=7的NH4Cl和NH3·H2O的混合溶液中,OH-数为10-7NA |
| C.42 g丙烯中含有的共价键数目为9NA |
| D.两份均为2.7 g的铝样品分别与100 mL浓度均为2 mol·L-1的盐酸和氢 |
设NA为阿伏加德罗常数的数值,下列叙述错误的是( )。
| A.标准状况下,11.2 L氢气中含有1 mol质子 |
| B.12 g金刚石含有的共价键数为4NA |
| C.46 g NO2和N2O4混合气体中含有原子总数为3NA |
| D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
设NA为阿伏加德罗常数的值,下列叙述错误的是( )。
| A.标准状况下,22.4 L SO2和O2的混合气体中含有的氧原子数为2NA |
| B.标准状况下,22.4 L乙烯中含有共用电子对的数目为6NA |
| C.密闭容器中,3 mol H2和1 mol N2在高温、高压、催化剂的条件下充分反应后,容器内的气体分子总数为2NA |
| D.2.8 g的CO和2.8 g的N2所含质子数都为1.4NA |
在T ℃时,将a gNH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,其中含有NH的物质的量为b mol。下列叙述中正确的是( )。
A.溶质的质量分数为w=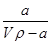 ×100% ×100% |
B.溶质的物质的量浓度c=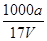 mol·L-1 mol·L-1 |
C.溶液中c(OH-)=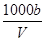 mol·L-1 mol·L-1 |
| D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5 w |