题目内容
中学化学实验中,淡黄色的pH试纸常用于测定溶液的酸碱性.在25℃时,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色.而要精确测定溶液的pH,需用pH计.pH计主要通过测定溶液中H+浓度来测定溶液的pH.
(1)已知水中存在如下平衡:H2O+H2O?H3O++OH-△H>0
现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是 (填字母).
A.在水中加入H2SO4 B.向水中加入Fe2(SO4)3
C.加热水至100℃[其中c(H+)=1×10-6mol?L-1]D.向水中加入NaHSO4
(2)现欲测定100℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显 色;若用pH计测定,则pH 7(填“>”、“<”或“=”),溶液呈 性(填“酸”、“碱”或“中”).
(1)已知水中存在如下平衡:H2O+H2O?H3O++OH-△H>0
现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是
A.在水中加入H2SO4 B.向水中加入Fe2(SO4)3
C.加热水至100℃[其中c(H+)=1×10-6mol?L-1]D.向水中加入NaHSO4
(2)现欲测定100℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)使水的电离平衡向右移动的方法有:升高温度、加入含有弱根离子的盐等,如果溶液呈酸性,说明加入的物质和氢氧根离子反应,导致溶液中氢氧根离子浓度小于氢离子浓度而使溶液呈酸性;
(2)100℃沸水显示中性,根据中性环境下pH试纸的颜色来确定即可;在25℃时,水的pH=7,温度升高,则pH增大,水在任何温度下均为中性.
(2)100℃沸水显示中性,根据中性环境下pH试纸的颜色来确定即可;在25℃时,水的pH=7,温度升高,则pH增大,水在任何温度下均为中性.
解答:
解:(1)A.在水中加入H2SO4,硫酸溶解后电离出氢离子,抑制水电离,平衡向左移动,且溶液中C(H+)>C(OH-),溶液呈酸性,故错误;
B.向水中加入Fe2(SO4)3,Fe2(SO4)3是强酸弱碱盐能水解,铁离子和氢氧根离子结合生成氢氧化铁,从而促进水电离,导致溶液中C(OH-)<C(H+),溶液呈酸性,故正确;
C.水的电离是吸热反应,加热至100℃,促进水电离,溶液C(OH-)=C(H+),溶液呈中性,故错误;
D.向水中加入NaHSO4,NaHSO4电离出氢离子,抑制水电离,平衡逆向移动,导致溶液中C(H+)>C(OH-),溶液呈酸性,故错误;
故选B;
(2)100℃沸水仍然是中性的,pH试纸测定溶液的酸碱性时,中性溶液不变色,所以是淡黄色的,温度升高会促进水的电离,所以水的pH会减小,水在任何温度下均为中性的,故答案为:淡黄;<;中.
B.向水中加入Fe2(SO4)3,Fe2(SO4)3是强酸弱碱盐能水解,铁离子和氢氧根离子结合生成氢氧化铁,从而促进水电离,导致溶液中C(OH-)<C(H+),溶液呈酸性,故正确;
C.水的电离是吸热反应,加热至100℃,促进水电离,溶液C(OH-)=C(H+),溶液呈中性,故错误;
D.向水中加入NaHSO4,NaHSO4电离出氢离子,抑制水电离,平衡逆向移动,导致溶液中C(H+)>C(OH-),溶液呈酸性,故错误;
故选B;
(2)100℃沸水仍然是中性的,pH试纸测定溶液的酸碱性时,中性溶液不变色,所以是淡黄色的,温度升高会促进水的电离,所以水的pH会减小,水在任何温度下均为中性的,故答案为:淡黄;<;中.
点评:本题考查学生会的电离方面的知识,注意教材知识的梳理是解题的关键,难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、油脂、淀粉、蔗糖和葡萄糖在一定条件都能发生水解反应 |
| B、蛋白质是结构复杂的高分子化合物,分子中都含有C、H、O、N四种元素 |
| C、棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O |
| D、氨基酸、淀粉均属于高分子化合物 |
某烃1mol最多能和2mol HBr加成反应,其所得的产物又能跟8mol Br2发生取代反应,最后得到一种只含碳、溴两种元素的化合物,则原烃为( )
| A、C2H2 |
| B、C3H4 |
| C、C3H6 |
| D、C4H6 |
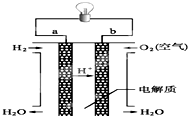 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.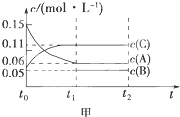 向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体.一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出],t1时刻达到平衡,反应过程中混合气体的平均相对分子质量始终不变.请回答:
向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体.一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出],t1时刻达到平衡,反应过程中混合气体的平均相对分子质量始终不变.请回答: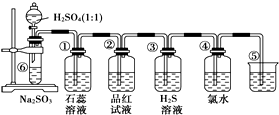 如图是实验室制备SO2并验证SO2某些性质的装置图.试回答
如图是实验室制备SO2并验证SO2某些性质的装置图.试回答