题目内容
乙炔是无色无味的气体,实验室制的乙炔因电石中含有 CaS、Ca3P2等,与水反应,产生H2S、PH3等气体,所以所制乙炔气体会有难闻的臭味;
(1)去除乙炔的臭味,通常选用 试剂.
(2)H2S对本实验的影响是: .
(3)将乙炔气体通入溴水溶液中,可以观察到 ,说明乙炔与溴发生反应.其化学反应方程式为 .
(1)去除乙炔的臭味,通常选用
(2)H2S对本实验的影响是:
(3)将乙炔气体通入溴水溶液中,可以观察到
考点:乙炔炔烃
专题:有机物的化学性质及推断
分析:(1)实验室用电石和饱和食盐水反应制备乙炔,生成的气体中含有H2S和PH3,二者都和硫酸铜反应,可用硫酸铜除去.
(2)H2S具有还原性,能与溴水反应,溴水褪色,易能被高锰酸钾氧化,溶液褪色;
(3)乙炔能使溴的四氯化碳溶液褪色发生加成反应.
(2)H2S具有还原性,能与溴水反应,溴水褪色,易能被高锰酸钾氧化,溶液褪色;
(3)乙炔能使溴的四氯化碳溶液褪色发生加成反应.
解答:
解:(1)H2S和PH3都能和硫酸铜溶液反应,因此可以用硫酸铜溶液除去该杂质气体;
故答案为:硫酸铜.
(2)H2S具有还原性,能与溴水反应,溴水褪色,易能被高锰酸钾氧化,溶液褪色,对实验造成干扰;
故答案为:H2S能与溴水反应,溴水褪色,易能被高锰酸钾氧化,溶液褪色,对实验造成干扰;
(3)乙炔能够和溴水发生加成反应,方程式为:CH≡CH+2Br2→CHBr2CHBr2,溴水褪色;
故答案为:溴水褪色;CH≡CH+2Br2→CHBr2CHBr2.
故答案为:硫酸铜.
(2)H2S具有还原性,能与溴水反应,溴水褪色,易能被高锰酸钾氧化,溶液褪色,对实验造成干扰;
故答案为:H2S能与溴水反应,溴水褪色,易能被高锰酸钾氧化,溶液褪色,对实验造成干扰;
(3)乙炔能够和溴水发生加成反应,方程式为:CH≡CH+2Br2→CHBr2CHBr2,溴水褪色;
故答案为:溴水褪色;CH≡CH+2Br2→CHBr2CHBr2.
点评:本题主要考查了物质的制备与除杂,难度不大,注意物质性质的掌握.

练习册系列答案
相关题目
类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确最终要经过实验的验证.以下类推的结论正确的是( )
| A、由“Cl2+H2O═HCl+HClO”可推出“F2+H2O═HF+HFO” |
| B、HCl的水溶液是强酸,推出HF的水溶液也是强酸 |
| C、由“2Fe+3Cl2═2FeCl3”可推出“2Fe+3I2═2FeI3” |
| D、Na常温下与水剧烈反应,故K常温下也能与水剧烈反应 |
现有m mol NO2和n mol NO组成的混合气体,欲用a mol/L NaOH溶液使该混合气体全部转化成盐NaNO3或NaNO2进入溶液,需用该NaOH溶液的体积是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
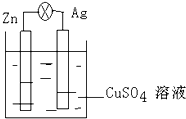 如图所示,在银锌原电池中,以硫酸铜为电解质溶液,锌为
如图所示,在银锌原电池中,以硫酸铜为电解质溶液,锌为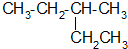 的系统命名为
的系统命名为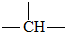 和一个-F,符合此要求的可能结构有
和一个-F,符合此要求的可能结构有