题目内容
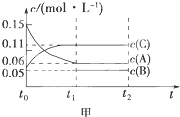 向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体.一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出],t1时刻达到平衡,反应过程中混合气体的平均相对分子质量始终不变.请回答:
向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体.一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出],t1时刻达到平衡,反应过程中混合气体的平均相对分子质量始终不变.请回答:(1)写出该反应的化学方程式
(2)若t1=15s,则用B的浓度变化表示的t0~t1阶段的平均反应速率为
(3)反应起始时B的体积分数为
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)A的浓度减小为反应物,C的浓度增大为生成物,且反应前后计量数相同,根据反应物质的变化量之比等于计量数比求算;
(2)根据图象中C的浓度变化求算其反应速率,然后速率之比等于对应物质的化学计量数之比;
(3)由图可知,c(A起始)=0.15mol/L,n(A起始)=0.3mol,所以体积为2L,反应后的总物质的量为(0.11mol/L+0.06mol/L+0.05mol/L)×2L=0.44mol,以此解答.
(2)根据图象中C的浓度变化求算其反应速率,然后速率之比等于对应物质的化学计量数之比;
(3)由图可知,c(A起始)=0.15mol/L,n(A起始)=0.3mol,所以体积为2L,反应后的总物质的量为(0.11mol/L+0.06mol/L+0.05mol/L)×2L=0.44mol,以此解答.
解答:
解:(1)A的浓度较小为反应物,A的浓度变化为:0.15mol/L-0.06mol/L=0.09mol/L,C的浓度增大为生成物,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,则A、C的计量数之比为3:2,在反应过程中混合气体的平均分子量没有变化,则反应前后计量数相同,所以B为生成物,且计量数为1,所以反应方程式为:3A?B+2C,故答案为:3A?B+2C;
(2)由图象C的浓度变化为c(C)=0.11mol/L-0.05mol/L=0.06mol/L,则其反应速率为v(C)=
=
=0.004 mol?L-1?s-1,所以v(B)=
=0.002mol/L,故答案为:0.002mol/L;
(3)又由图可知,c(A起始)=0.15mol/L,n(A起始)=0.3mol,所以体积为2L,反应后的总物质的量为(0.11mol/L+0.06mol/L+0.05mol/L)×2L=0.44mol,所以起始B的物质的量为0.44mol-0.3mol-0.1mol=0.04mol,体积之比等于物质的量之比,即
×100%=9.1%,所以,反应起始时B的体积分数为9.1%,故答案为:9.1%.
(2)由图象C的浓度变化为c(C)=0.11mol/L-0.05mol/L=0.06mol/L,则其反应速率为v(C)=
| △c |
| △t |
| 0.06mol/L |
| 15s |
| v(C) |
| 2 |
(3)又由图可知,c(A起始)=0.15mol/L,n(A起始)=0.3mol,所以体积为2L,反应后的总物质的量为(0.11mol/L+0.06mol/L+0.05mol/L)×2L=0.44mol,所以起始B的物质的量为0.44mol-0.3mol-0.1mol=0.04mol,体积之比等于物质的量之比,即
| 0.04mol |
| 0.44mol |
点评:本题考查了反应速率的计算、反应方程式的确定等,题目涉及的内容较多,侧重于考查学生对所学知识的综合应用能力,题目难度中等.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
联合国把2011年定为“国际化学年”,纪念化学所取得的成就以及对人类文明的贡献.下列说法不正确的是( )
| A、化学是一门具有创造性的科学,是自然科学中创造新物质最多的科学领域 |
| B、现代化学的发展促进了社会的文明,提高了人类生活的质量 |
| C、化学合成的物质均有毒性,绝对不能食用 |
| D、普及化学知识,可以提高公众科学素养 |
下列各组物质中,制备装置、收集装置均相同,且都可用浓H2SO4干燥的是( )
| A、SO2和H2S |
| B、NO和NH3 |
| C、NO2和H2 |
| D、SO2和CO2 |
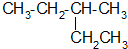 的系统命名为
的系统命名为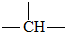 和一个-F,符合此要求的可能结构有
和一个-F,符合此要求的可能结构有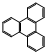 的一氯取代物有
的一氯取代物有 的二氯取代物有
的二氯取代物有