题目内容
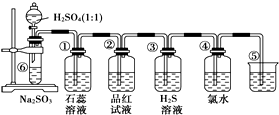 如图是实验室制备SO2并验证SO2某些性质的装置图.试回答
如图是实验室制备SO2并验证SO2某些性质的装置图.试回答(1)⑥中发生的化学反应方程式为
(2)②中实验现象是
(3)⑤的作用是
考点:性质实验方案的设计,制备实验方案的设计
专题:实验设计题
分析:实验室制SO2并验证SO2某些性质,⑥中硫酸与亚硫酸钠反应生成二氧化硫,①中二氧化硫与水反应生成亚硫酸,遇石蕊变红;②中品红溶液褪色;③中二氧化硫与硫化氢发生氧化还原反应生成单质S;④中二氧化硫与碘水发生氧化还原反应生成硫酸和HI酸;⑤为尾气处理装置,二氧化硫与NaOH反应可防止二氧化硫排放在环境中,以此来解答.
解答:
解:由图可知,⑥中硫酸与亚硫酸钠反应生成二氧化硫,①中二氧化硫与水反应生成亚硫酸,遇石蕊变红;②中品红溶液褪色;③中二氧化硫与硫化氢发生氧化还原反应生成单质S;④中二氧化硫与碘水发生氧化还原反应生成硫酸和HI酸;⑤为尾气处理装置,二氧化硫与NaOH反应可防止二氧化硫排放在环境中,
(1)⑥中硫酸与亚硫酸钠反应生成二氧化硫气体,反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)因二氧化硫具有漂白性,则②中的品红溶液褪色或变浅,③中二氧化硫与硫化氢发生氧化还原反应生成单质S,该反应为SO2+2H2S═3S↓+2H2O,
故答案为:品红试液褪色或变浅;S、H2O;
(3)⑤中的作用是吸收二氧化硫,防止二氧化硫污染环境,发生的化学反应为SO2+2NaOH═Na2SO3+H2O,离子反应为SO2+2OH-═SO32-+H2O,
故答案为:吸收过量的SO2,防止污染环境;SO2+2OH-═SO32-+H2O.
(1)⑥中硫酸与亚硫酸钠反应生成二氧化硫气体,反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)因二氧化硫具有漂白性,则②中的品红溶液褪色或变浅,③中二氧化硫与硫化氢发生氧化还原反应生成单质S,该反应为SO2+2H2S═3S↓+2H2O,
故答案为:品红试液褪色或变浅;S、H2O;
(3)⑤中的作用是吸收二氧化硫,防止二氧化硫污染环境,发生的化学反应为SO2+2NaOH═Na2SO3+H2O,离子反应为SO2+2OH-═SO32-+H2O,
故答案为:吸收过量的SO2,防止污染环境;SO2+2OH-═SO32-+H2O.
点评:本题考查物质制备实验及性质实验,题目难度中等,明确各装置的作用及发生的化学反应是解答本题的关键,注意掌握二氧化硫的性质及检验方法.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
下列有关盐类水解的说法不正确的是( )
| A、盐类水解过程破坏了纯水的电离平衡 |
| B、盐类水解反应是酸碱中和反应的逆反应 |
| C、盐类水解的结果使溶液不一定呈中性 |
| D、Na2S溶液中c(Na+)是c(S2-)的2倍 |
现有m mol NO2和n mol NO组成的混合气体,欲用a mol/L NaOH溶液使该混合气体全部转化成盐NaNO3或NaNO2进入溶液,需用该NaOH溶液的体积是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列说法正确的是( )
| A、沸点:H2O>H2S>H2Se>H2Te |
| B、稳定性:SiH4>PH3>H2S>HCl |
| C、熔点:SiC>KCl>I2>CO2 |
| D、沸点:CH4>SiH4>GeH4>SnH4 |
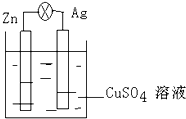 如图所示,在银锌原电池中,以硫酸铜为电解质溶液,锌为
如图所示,在银锌原电池中,以硫酸铜为电解质溶液,锌为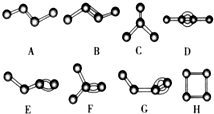 如图是化学必修2第64页配图(氢原子已省略),请根据下图回答有关问题.
如图是化学必修2第64页配图(氢原子已省略),请根据下图回答有关问题. 的一氯取代物有
的一氯取代物有 的二氯取代物有
的二氯取代物有