题目内容
【题目】Ⅰ.把5.1 g镁铝合金的粉末放入过量的盐酸中,得到5.6 L H2(标准状况下)。
(1)合金中镁的物质的量为_______。
(2)写出该合金溶于足量NaOH溶液的化学方程式:_______。
Ⅱ.在一定质量的AlCl3和MgCl2混合溶液中逐渐滴入一定溶质质量分数的NaOH溶液,生成沉淀的物质的量与加入NaOH的物质的量的关系如图所示。
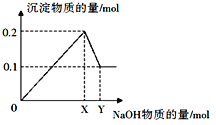
(1)生成Mg(OH)2的质量为__________。
(2)X=_______;Y=_________。
【答案】 0.1mol 2Al+2NaOH+2H2O===2NaAlO2+3H2↑ 5.8g 0.5 0.6
【解析】Ⅰ.设镁、铝合金中的物质的量镁为xmol、铝为 ymol;根据电子守恒得:2x+3y=2×5.6/22.4,根据质量守恒得:24x+27y=5.1,解得:x=0.1mol,y=0.1 mol;
(1)合金中镁的物质的量为0.1mol;正确答案:0.1mol。
(2)镁与NaOH溶液不反应,铝与NaOH溶液反应生成偏铝酸钠和氢气,化学方程式:2Al+2NaOH+2H2O===2NaAlO2+3H2↑;正确答案:2Al+2NaOH+2H2O===2NaAlO2+3H2↑。
Ⅱ.通过图像可知,Mg(OH)2和Al(OH)3沉淀的总量为0.2 mol,继续加入NaOH溶液,Al(OH)3沉淀完全溶解,而Mg(OH)2不溶,则Mg(OH)2的量为0.1 mol,其质量为0.1×58=5.8 g ,Al(OH)3的量为0.1 mol;根据元素守恒关系:AlCl3和MgCl2的量均为0.1 mol,根据关系式可知:Al3+--3OH- Mg2+--2OH-,n(NaOH)=0.1×3+0.1×2=0.5 mol,即X=0.5 mol;根据Al(OH)3+NaOH= NaAlO2+ 2H2O可知:消耗n(NaOH)=0.1 mol;即Y =0.5+0.1=0.6 mol;正确答案:5.8g; 0.5 ; 0.6。

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案【题目】1000 mL某待测溶液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种如下表,现进行如下实验操作(每次实验所加试剂均过量):
阳离子 | K+、NH |
阴离子 | Cl-、Br-、CO |
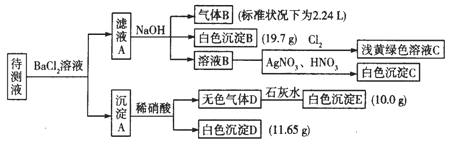
(1)写出生成白色沉淀B的离子方程式:_________。
(2)待测液中肯定不存在的阳离子是_______。
(3)若无色气体D是单一气体:判断原溶液中K+是否存在____(填“是”或“否”),若存在,求其物质的量浓度的最小值,若不存在,请说明理由:__________。
【题目】将等物质的量X和Y加入密闭容器,在一定条件下发生反应:X(g)+Y(g)Z (s)+2W(g),平衡时W的体积分数(%)随温度和压强的变化如表所示.
1.0 MPa | 2.0 MPa | 3.0 MPa | |
800℃ | a | b | 83% |
900℃ | c | 75% | d |
1000℃ | 54% | e | f |
①a>c>f ②900℃、2.0MPa时,X的转化率为75% ③该反应的△H<0 ④平衡常数K(1000℃)>K(800℃)上述①~④中正确的有( )
A.4个
B.3个
C.2个
D.1个