��Ŀ����
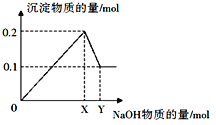
����Ŀ���������ʵ���X��Y�����ܱ���������һ�������·�����Ӧ��X��g��+Y��g��Z ��s��+2W��g����ƽ��ʱW�����������%�����¶Ⱥ�ѹǿ�ı仯�����ʾ��
1.0 MPa | 2.0 MPa | 3.0 MPa | |
800�� | a | b | 83% |
900�� | c | 75% | d |
1000�� | 54% | e | f |
��a��c��f ��900�桢2.0MPaʱ��X��ת����Ϊ75% �۸÷�Ӧ�ġ�H��0 ��ƽ�ⳣ��K��1000�棩��K��800�棩�����١�������ȷ���У� ��
A.4��
B.3��
C.2��
D.1��
���𰸡�B
���������⣺��X��g��+Y��g��Z ��s��+2W��g������Ӧǰ��������������䣬����ͬ�¶��£�����Ӱ��ƽ���ƶ�����a=b=83%��c=d=75%��e=f=54%����a��c��f������ȷ����900��ʱ
X��g��+ | Y��g�� | Z ��s��+ | 2W��g�� | ||
��ʼ | n | n | 0 | ||
ת�� | x | x | 2x | ||
ƽ�� | n��x | n��x | 2x |
�� ![]() =75%�����x=
=75%�����x= ![]() n����900�桢2.0MPaʱ��X��ת����Ϊ
n����900�桢2.0MPaʱ��X��ת����Ϊ ![]() ��100%=75%������ȷ��
��100%=75%������ȷ��
���ɱ������ݿ�֪���¶�Խ�ߣ�ƽ��ʱW���������ԽС���������¶ȣ�ƽ�������ƶ�������ӦΪ���ȷ�Ӧ������H��0������ȷ��
�ܷ��ȷ�Ӧ���¶�Խ�ߣ�KԽС��ƽ�ⳣ��K��1000�棩��K��800�棩���ʴ���
��ѡB��
�����㾫����������Ŀ����֪���������û�ѧƽ��ļ�������֪ʶ���Եõ�����Ĵ𰸣���Ҫ���շ�Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��

 ϰ�⾫ѡϵ�д�
ϰ�⾫ѡϵ�д�����Ŀ�����в������ܴﵽĿ���ǣ� ��
ѡ�� | Ŀ�� | ���� |
A | ����100mL1.0molL��1CuSO4 | ��25.0gCuSO45H2O��������ˮ���100mL��Һ |
B | ��ȥKNO3����������NaCl | ��������Ƴ��ȵı�����Һ����ȴ�ᾧ������ |
C | ������Һ�Ƿ���SO | ȡ��������Һ���Թ��У����������ữ��Ba��NO3��2��Һ |
D | ������Һ���Ƿ���NH | ȡ������Һ���Թ��У�����NaOH���ȣ����Թܿڷ���һƬʪ��ĺ�ɫʯ����ֽ |
A.A
B.B
C.C
D.D