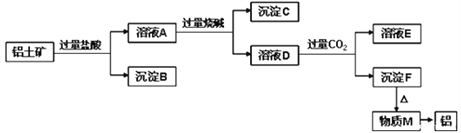
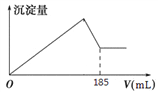
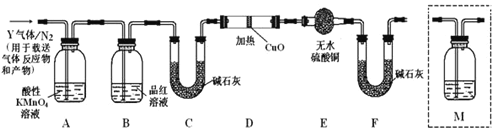
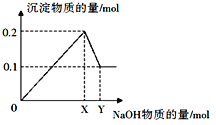
题目内容
【题目】A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如下图所示.A元素的某种同位素原子没有中子,D元素的原子序数是C的2倍,E是短周期主族元素中半径最大的元素.下列说法不正确的是( )
A.简单离子的半径大小关系:B>C>E
B.D,E两种元素形成的化合物,可能含有离子键和共价键
C.A,B,C三种元素形成的化合物,晶体类型一定相同
D.B,D分别和C形成的化合物,都有可能使溴水或品红溶液褪色
【答案】C
【解析】A.N3-、O2-、Na+具有相同的电子层结构,质子数越大,离子半径越小,则离子半径N3->O2->Na+ , 即B>C>E,A项不符合题意;
B.D、E能形成Na2S,Na2S2等化合物,含有离子键和共价键,B项不符合题意;
C. A、B、C三种元素形成的化合物有硝酸、硝酸铵等,硝酸是分子晶体,硝酸铵是离子晶体,晶体类型不相同,C项符合题意;
D. B、D分别和C形成的化合物是NO2、SO2 , 都有可能使溴水或品红溶液褪色,D项不符合题意;
答案选C。

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
【题目】下列操作不能达到目的是( )
选项 | 目的 | 操作 |
A | 配制100mL1.0molL﹣1CuSO4 | 将25.0gCuSO45H2O溶于蒸馏水配成100mL溶液 |
B | 除去KNO3固体中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
C | 检验溶液是否含有SO | 取少量待测液于试管中,加入硝酸酸化的Ba(NO3)2溶液 |
D | 检验溶液中是否含有NH | 取少量溶液于试管中,加入NaOH后,加热,在试管口放置一片湿润的红色石蕊试纸 |
A.A
B.B
C.C
D.D