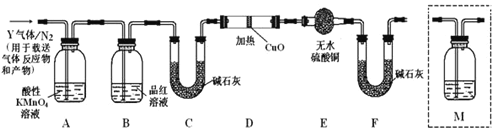
题目内容
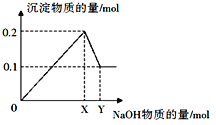
【题目】现有200mL MgCl2、AlCl3的混合液,其中c(Mg2+)=0.2mol·L-1 ,c(Cl-)=1.3 mol·![]() 。要使Mg2+转化成Mg(OH)2,并使Mg2+和Al3+分离开来,至少需要4 mol·L-1的NaOH溶液
。要使Mg2+转化成Mg(OH)2,并使Mg2+和Al3+分离开来,至少需要4 mol·L-1的NaOH溶液
A. 140mL B. 120mL C. 100mL D. 80mL
【答案】D
【解析】
试题分析:要使Mg2+全部转化为沉淀分离出来,则铝离子应该恰好转化为偏氯酸钠,反应的方程式分别是Mg2++2OH-=Mg(OH)2、Al3++4OH-=〔Al(OH)4〕-。溶液中镁离子和氯离子的物质的量分别是0.2 mol/L×0.2L=0.04mol、1.3 mol/L×0.2L=0.26mol。所以根据溶液的电中性可知,溶液中铝离子的物质的量是![]() 。因此根据反应的方程式可知,至少需要氢氧化钠的物质的量是0.04mol×2+0.06mol×4=0.32mol,因此需要氢氧化钠溶液的体积是
。因此根据反应的方程式可知,至少需要氢氧化钠的物质的量是0.04mol×2+0.06mol×4=0.32mol,因此需要氢氧化钠溶液的体积是![]() ,答案选D。
,答案选D。

练习册系列答案
相关题目
【题目】下列操作不能达到目的是( )
选项 | 目的 | 操作 |
A | 配制100mL1.0molL﹣1CuSO4 | 将25.0gCuSO45H2O溶于蒸馏水配成100mL溶液 |
B | 除去KNO3固体中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
C | 检验溶液是否含有SO | 取少量待测液于试管中,加入硝酸酸化的Ba(NO3)2溶液 |
D | 检验溶液中是否含有NH | 取少量溶液于试管中,加入NaOH后,加热,在试管口放置一片湿润的红色石蕊试纸 |
A.A
B.B
C.C
D.D