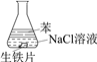题目内容
【题目】在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现有NO和NH3的混合物1mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。
(1)写出反应的化学方程式并标出电子转移的方向和数目______________。
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是____,_________。
【答案】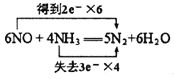 0.3molNO和0.7molNH3 0.2molNH3和0.8molNO
0.3molNO和0.7molNH3 0.2molNH3和0.8molNO
【解析】
反应的方程式为:6NO+4NH3=5N2+6H2O,根据化合价的变化判断电子转移的方向和数目;根据化学方程式以及经还原得到的N2比经氧化得到的N2多1.4g,利用讨论法计算原反应混合物中NO与NH3的物质的量。
(1)NO跟NH3可以发生反应生成N2和H2O ,根据电子守恒、原子守恒,可得反应的化学方程式:6NO+4NH3=5N2+6H2O。在该反应中,N元素的化合价由反应前NO中的+2价变为反应后N2中的0价,化合价降低2,获得2个电子,N元素的化合价由反应前NH3中的-3价变为反应后N2中的0价,化合价升高3,失去3个电子,根据化合价升降总数相等,等于元素化合价升降总数,可知NO的系数是3,NH3的系数是2,反应产生的N2的系数是5/2,H2O的系数是3,然后都扩大2倍,变为整数系数,可得该反应的电子转移表示式: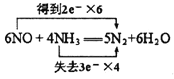 ;
;
(2)在反应方程式为6NO+4NH3=5N2+6H2O,该反应中氧化产物和还原产物都是氮气,根据方程式可知:若有6molNO发生反应,会消耗4molNH3,产生5molN2,还原产物比氧化产物多1mol,现在还原产物比氧化产物多1.4g,则还原产物比氧化产物多![]() =0.05mol,反应的NO的物质的量是0.3mol,反应的氨气的物质的量是0.2mol。由于二者的物质的量的和是1mol,所以过量的气体的物质的量是1mol-0.2mol-0.3mol=0.5mol。假设NO完全反应,则NO的物质的量=
=0.05mol,反应的NO的物质的量是0.3mol,反应的氨气的物质的量是0.2mol。由于二者的物质的量的和是1mol,所以过量的气体的物质的量是1mol-0.2mol-0.3mol=0.5mol。假设NO完全反应,则NO的物质的量=![]() ×6=0.3mol,氨气的物质的量是n(NH3)=1mol-0.3mol=0.7mol;假设氨气完全反应,则NH3的物质的量是0.2mol,则NO的物质的量=1mol-
×6=0.3mol,氨气的物质的量是n(NH3)=1mol-0.3mol=0.7mol;假设氨气完全反应,则NH3的物质的量是0.2mol,则NO的物质的量=1mol-![]() ×4=0.8mol,所以原反应混合物中NO与NH3的物质的量可能0.3molNO和0.7molNH3或0.2molNH3和0.8molNO。
×4=0.8mol,所以原反应混合物中NO与NH3的物质的量可能0.3molNO和0.7molNH3或0.2molNH3和0.8molNO。
故答案是:0.3molNO和0.7molNH3或0.2molNH3和0.8molNO。

 阅读快车系列答案
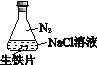
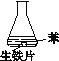
阅读快车系列答案【题目】研究生铁的锈蚀,下列分析不正确的是
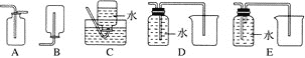
序号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 8小时未观察 到明显锈蚀 | 8小时未观察 到明显锈蚀 | 1小时观察 到明显锈蚀 |
A. ①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
B. ②中,生铁片未明显锈蚀的原因之一是缺少H2O
C. ③中正极反应:O2+4e+ 2H2O ==4OH
D. 对比①②③,说明苯能隔绝O2