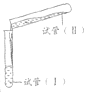
题目内容
【题目】MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。实验室模拟以MnO2为原料生产MnCO3的工艺流程如下:
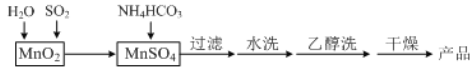
已知:MnCO3难溶于水和乙醇,受热易分解。
(1)实验室中过滤操作所用到的玻璃仪器有漏斗、烧杯、___。
(2)①检验水洗是否合格的方法是___。
(3)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为___;图中点D对应固体的成分为___(填化学式)。

【答案】玻璃棒 取最后一次洗涤液少许于一支试管中,向其中滴加盐酸酸化的氯化钡溶液,若无明显现象,说明水洗合格 1:2 Mn3O4与MnO
【解析】
(1)根据过滤操作装置图回答;
(2)根据流程图,MnCO3固体表面可能含有SO42-,根据洗涤液中是否含有SO42-检验水洗是否合格;
(2)根据元素守恒计算。
(1)过滤操作需要的仪器有有漏斗、烧杯、玻璃棒;
(2)根据硫酸根离子的检验方法,取最后一次洗涤液少许于一支试管中,向其中滴加盐酸酸化的氯化钡溶液,若无明显现象,说明水洗合格;
(3)设MnCO3的物质的量为1mol,即质量为115g;
A点剩余固体质量为115g×75.65%=87g,减少的质量为115g-87g=28g,可知MnCO3失去的组成为CO,故剩余固体的成分为MnO2,则300℃时,剩余固体中n(Mn):n(O)=1:2;
C点剩余固体质量为115g×61.74%=71g
据锰元素守恒知m(Mn)=55g,则m(O)1=71g-55g=16g;则n(Mn):n(O)=1:![]() =1:1;故剩余固体的成分为MnO;同理,B点剩余固体质量为115g×66.38%=76.337g;因m(Mn)=55g,则m(O)=76.337g-55g=21.337g;则n(Mn):n(O)=1:
=1:1;故剩余固体的成分为MnO;同理,B点剩余固体质量为115g×66.38%=76.337g;因m(Mn)=55g,则m(O)=76.337g-55g=21.337g;则n(Mn):n(O)=1:![]() =3:4;故剩余固体的成分为Mn3O4,因D点介于B、C之间,故D点对应固体的成分为Mn3O4与MnO的混合物。
=3:4;故剩余固体的成分为Mn3O4,因D点介于B、C之间,故D点对应固体的成分为Mn3O4与MnO的混合物。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】某学习小组学习了亚铁盐的性质后,欲探究FeSO4溶液分别与Na2CO3溶液、NaHCO3溶液的反应。已知:Fe(OH)2和FeCO3均为白色沉淀,不存在Fe(HCO3)2。实验操作及现象记录如下:
实验 | 试剂 | 操作及现象 | ||
试管(I) | 试管(II) | |||
(试管容积为50 mL) | 实验a | 1.0 mol·L-1 FeSO4溶液 24 mL | 1.0 mol·L-1 Na2CO3溶液24mL | 倾倒完后,迅速用胶塞塞紧试管I的口部,反复上下颠倒摇匀,使反应物充分混合 反应过程中无气泡产生,生成白色絮状沉淀 放置1.5~2 h后,白色絮状沉淀转化为白色颗粒状沉淀 |
实验b | 1.0 mol·L-1 FeSO4溶液 10 mL | 1.0 mol·L-1 NaHCO3溶液 20 mL | 倾倒完后,迅速产生白色颗粒状沉淀和大量气泡。振荡,经2~4 min后液面上方试管内壁粘附的白色颗粒状沉淀物变成红褐色 | |
(1)甲同学认为实验a中白色颗粒状沉淀是FeCO3,写出该反应的离子方程式:________;他为了证实自己的观点,进行实验:取少量白色颗粒状沉淀,加入________,发现产生大量气泡。
(2)乙同学推测实验a的白色颗粒状沉淀中还可能含有Fe(OH)2,他将实验a中两种溶液体积均改成15 mL后再进行实验,证实了他的推测。能证明Fe(OH)2存在的实验现象是_________。
(3)实验b中白色颗粒状沉淀主要成分也为FeCO3,写出生成FeCO3的离子方程式:________。
(4)实验b中液面上方试管内壁粘附的白色颗粒状沉淀物变成红褐色,主要原因是潮湿的FeCO3被氧气氧化,写出该反应的化学方程式:__________。
(5)乙同学反思,实验a中含有Fe(OH)2,实验b中几乎不含有Fe(OH)2,对比分析出现差异的原因是_________。
【题目】某无色溶液甲中仅含有下列离子的几种( 不考虑水的电离以及离子的水解);
阳离子 | K+、Al3+、Fe3+、Ba2+、NH4+ |
阴离子 | Cl-、CO32-、HCO3-、SO42- |
取100mL溶液甲并分成两等份进行如下实验(假设每步完全反应):
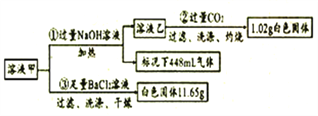
(1)由①可知,原溶液存在的离子有____,浓度为_____mol/L。
(2)写出实验②中生成沉淀的离子方程式_________。
(3)通入过量CO2充分反应后,需将反应后的混合溶液加热再过滤,其目的是_______。
(4)某同学通过分析认为该溶液中一定存在K+,其理由是________。