��Ŀ����
����Ŀ������֬�ް�סԼ0.2gNa2O2��ĩ������ʯ�����ϣ�����֬���ϵ�ˮ����ͼ1�����ɹ۲쵽��֬����ȼ��������
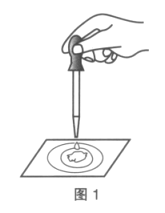
��1����ʵ���������ó����й�Na2O2��H2O��Ӧ�Ľ������£��벹��������
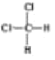
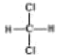
a.��___���ɣ�b.��Ӧ���ȣ�
Na2O2��ˮ��Ӧ�Ļ�ѧ����ʽ��__��
��2��ij�о���ѧϰС������ͼ2װ�ý���ʵ�飬��֤���������ۡ�
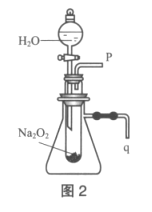
��������֤����a��ʵ�鷽������Һ©��������__��
��������֤����b��ʵ�鷽������Ӧǰ��q���ܿ�����һ�ܽ���ʢ��ˮ��ˮ���У�����ˮ�۲쵽___��֤����Ӧ�Ƿ��ȵġ�
��3��ʵ�飨2�����Թ��м�ˮ��������ȫ�ܽ��Ҳ������������ɺ�ȡ���Թܣ����Թ��е����̪��Һ��������Һ��죬��ɫ��ȥ�������ɫ���������Ϸ���ԭ��֮һ�Ƿ�Ӧ����Һ����H2O2��ʹ��̪����Ư�ס�ͬѧ����Ӧ����Һ�м���FeSO4��Һ���ɹ۲쵽__ɫ�������ɣ��÷�Ӧ�����ӷ���ʽ��__��
���𰸡�O2 2Na2O2+2H2O=4NaOH+O2�� �ô����ǵ�ľ������p���ܿڣ����۲쵽ľ����ȼ��֤����O2���� ������ð�� ��� 2Fe2++H2O2+4OH-=2Fe(OH)3��
��������
��1����֬����ȼ�գ�˵���߱�ȼ������������ȼ�յ��������÷�ӦΪ���ȷ�Ӧ�������������ɣ���ѧ��Ӧ����ʽΪ��2Na2O2+2H2O=4NaOH+O2�����ʴ�Ϊ��O2��2Na2O2+2H2O=4NaOH+O2����
��2������������ʹ�����ǵ�ľ����ȼ�����ʣ����Կ��ô����ǵ�ľ������p�������ľ����ȼ�������������ɣ���֮���������ɣ��ʴ�Ϊ���ô����ǵ�ľ������p���ܿڣ����۲쵽ľ����ȼ��֤����O2���ɣ�
����������������������ʣ�����÷�Ӧ���ȣ��ų���������ʹ����ƿ�ڿ�����ѹǿ�������q���ܲ���ʢˮ��С�ձ��У�������ð����֤���˷�Ӧ���ȣ��ʴ�Ϊ��������ð����
��3����Ӧ����Һ�У������̪��Һ��������Һ��죬˵����Һ�Լ��ԣ���ɫ��ȥ����H2O2��H2O2����ǿ�����ԣ��ڼ��������£�FeSO4��H2O2�����������������ĺ��ɫ�����������ӷ�Ӧ����ʽΪ��2Fe2++H2O2+4OH-=2Fe(OH)3�����ʴ�Ϊ����֣�
2Fe2++H2O2+4OH-=2Fe(OH)3����