题目内容
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数。
(1)在CB3分子中C元素原子的原子轨道发生的是___杂化,CB3分子的空间构型为___。
(2)C的氢化物极易溶于水的原因是___。
(3)D元素与同周期相邻元素的第一电离能由大到小的关系是:___(用元素符号表示);
(4)氧原子的价层电子的轨道表示式为___。
【答案】sp3杂化 三角锥形 氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应,故氨气极易溶于水 Cl>P>S ![]()
【解析】
B原子得一个电子后3p轨道全满,则B的基态原子电子排布为1s22s22p63s23p5,B应该是氯元素。又因为A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,所以A是钠元素。C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,所以C是氮元素。D的最高化合价和最低化合价的代数和为4,则D是第ⅥA族元素。最高价氧化物中含D的质量分数为40%,则有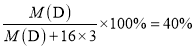 ,解得:M(D)=32。且其核内质子数等于中子数,所以D是16号元素S元素。据此分析。
,解得:M(D)=32。且其核内质子数等于中子数,所以D是16号元素S元素。据此分析。
(1)由分析可知,CB3分子为NCl3分子,N原子有一对孤对电子,与Cl原子成3个σ键,N原子轨道发生sp3杂化,所以NCl3分子的VSEPR模型为四面体形,忽略孤电子对,NCl3分子的空间构型为三角锥形;答案为:sp3杂化;三角锥形;
(2) C的氢化物为氨气,氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应,故氨气极易溶于水。答案为:氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应,故氨气极易溶于水;
(3)D元素为S元素,其同周期相邻元素分别为P、Cl,根据同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素,所以P、S、Cl元素的第一电离能大小顺序是:Cl>P>S;答案为:Cl>P>S;
(4)基态氧原子共有6个价电子,根据核外电子排布规律可知,氧原子的价层电子的轨道表示式为![]() ;答案为:
;答案为:![]() 。
。

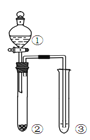
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D