题目内容
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
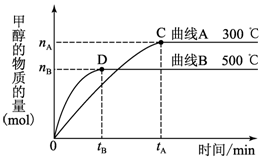
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题: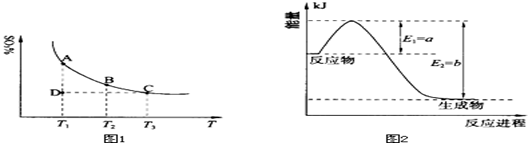
①恒温、恒压条件下,反应2SO2(g)+O2(g) 2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2(填“>”、“<”或“=”,下同);若反应进行到状态D时,v正 v逆(填“>”、“<”或“=”,下同)。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①上图2是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: .
(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水.在25℃下,将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液恰好显中性,用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)已知25°C时Ksp[AgCl]=1.6×10-10mol2?L-2,Ksp[AgI]=1.5×10-16mol2?L-2),在25℃下,向0.1L0.002mol?L-1的NaCl溶液中逐滴加入0.1L0.002mol?L-1硝酸银溶液,有白色沉淀生成.从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1L0.002mol?L-1的NaI 溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(1)① 向左 ② > , >
(2)①N2(g)+3H2(g) 2NH3(g)△H=-2(b-a)kJ?mol-1 (其他合理答案也可给分)
2NH3(g)△H=-2(b-a)kJ?mol-1 (其他合理答案也可给分)
② 10-7b/(a-b)
(3)c(Ag+)(Cl-)大于溶度积Ksp(AgCl), 白色沉淀转化为黄色沉淀 AgCl(s)+I-═AgI(s)+Cl-
解析试题分析:(1)①恒温、恒压条件下,反应达平衡,向体系中通入氦气,容器的容积增大,相当于减小压 强,平衡向气体体积增大的逆向移动,即平衡向左移动;②由图1可知,随着温度的升高,混合体系中SO3的百分含量逐渐减小,说明升高温度平衡向逆反应进行,升高温度向吸热反应方向移动,则该反应正向为放热反应;温度为T1<T2,则反应的平衡常数K1>K2;D点未达平衡,混合体系中SO3的百分含量小于平衡时的百分含量,反应向正反应进行,v正 >v逆;
(2)①由图2可知,N2和H2反应生 成1molNH3放出的热量为(b-a)kJ,该反应的热化学反应方程式为N2(g)+3H2(g) 2NH3(g)△H=-2(b-a)kJ?mol-1;②将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,溶液中c(NH4+)=c(Cl-)=b/2mol/L,反应后c(NH3?H2O)=(a-b)/2mol/L,代入一水合氨电离常数表达式计算得电离常数为10-7b/(a-b);
2NH3(g)△H=-2(b-a)kJ?mol-1;②将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,溶液中c(NH4+)=c(Cl-)=b/2mol/L,反应后c(NH3?H2O)=(a-b)/2mol/L,代入一水合氨电离常数表达式计算得电离常数为10-7b/(a-b);
(3)在25℃下,向0.1L0.002mol?L-1的NaCl溶液中逐滴加入0.1L0.002mol?L-1硝酸银溶液,混合液反应前氯离子和银离子浓度均为0.001mol?L-1,c(Ag+)(Cl-)=1×10-6大于溶度积Ksp(AgCl),有白色沉淀生成;向反应后的浊液中,继续加入0.1L0.002mol?L-1的NaI溶液,由于氯化银和碘化银阴阳离子个数
比相同,溶度积越大,溶解度越大,即AgCl比AgI的溶解度大,根据沉淀转化的方向知,沉淀易向更难溶的方向转化,即由AgCl转化为更难溶的AgI,现象为白色沉淀转化为黄色沉淀,离子方程式为AgCl(s)+I-═AgI(s)+Cl-。
考点:考查化学平衡图像、热化学方程式书写、电离常数计算及沉淀溶解平衡。

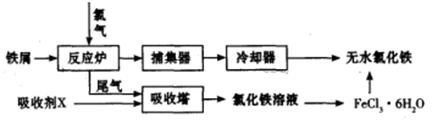
X、Y、Z、W均为10电子的分子或离子。X有5个原子核。通常状况下,W为无色液体。它们之间转化关系如图所示,请回答: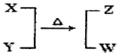
(1)工业上每制取1molZ要放出46.2 kJ的热量,写出该反应的热化学方程式: 。
(2)工业制取Z的化学平衡常数K与T的关系如下表:
| T/K | 298 | 398 | 498 | …… |
| K/(mol·L—1)—2 | 4.1×106 | K1 | K2 | …… |
请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②恒温固定体积的容器中,下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。
A.容器内各物质的浓度之比为化学计量数比
B.混合气体密度保持不变
C.容器内压强保持不变
D.混合气体相对分子质量保持不变
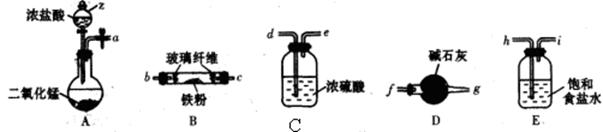
(3)某化学小组同学模拟工业生产制取HNO3,设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。

①A中发生反应的化学方程式是 。
②B中浓H2SO4的作用是 。
(4)写出D装置中反应的化学方程式 。
(5)a中通入空气的作用 。
 CO2(g) ΔH1<0①
CO2(g) ΔH1<0①
 H2(g)+CO2(g) ΔH2;
H2(g)+CO2(g) ΔH2;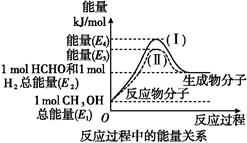
 H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1 CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图:
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图:


 Fe3+(aq)+3OH-(aq) △H=a kJ/mol
Fe3+(aq)+3OH-(aq) △H=a kJ/mol