题目内容
(1)生产水煤气过程中有以下反应:①C(s)+CO2(g)??2CO(g) ΔH1;
②CO(g)+H2O(g)  H2(g)+CO2(g) ΔH2;
H2(g)+CO2(g) ΔH2;
③C(s)+H2O(g)  CO(g)+H2(g) ΔH3;
CO(g)+H2(g) ΔH3;
上述反应ΔH3与ΔH1、ΔH2之间的关系为__________________________________。
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为
2CH4(g)+3O2(g)  2CO(g)+4H2O(g)
2CO(g)+4H2O(g)
ΔH=-1 038 kJ·mol-1。
工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同):
①X在750 ℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600 ℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440 ℃时催化效率最高,能使逆反应速率加快约1×106倍;
根据上述信息,你认为在生产中应该选择的适宜催化剂是________(填“X”或“Y”或“Z”),选择的理由是________________________________________________________;
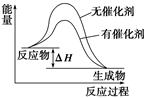
(3)请画出(2)中反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(1)ΔH3=ΔH1+ΔH2
(2)Z 催化效率最高其活性温度低,节能(或催化活性高、速度快、反应温度低)
(3)
解析

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案为保护环境并缓解能源危机,专家提出利用太阳能促使燃烧循环使用的构想,转化关系如图所示。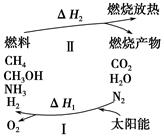
已知:
(1)过程Ⅰ可用如下反应表示:①2CO2 2CO+O2
2CO+O2
②2H2O(g) 2H2+O2
2H2+O2
③2N2+6H2O 4NH3+3O2
4NH3+3O2
④2CO2+4H2O 2CH3OH+3O2
2CH3OH+3O2
⑤2CO+4H2O ________+3O2。
________+3O2。
(2)25 ℃时,a g CH4完全燃烧释放出b kJ热量。下列说法不正确的是( )。
| A.过程Ⅰ是将太阳能转化成化学能 |
| B.反应⑤的另一种产物为CH4 |
| C.ΔH1=-ΔH2 |
| D.表示甲烷燃烧热的热化学反应方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-16b kJ·mol-1 |
 H2O(l) ΔH="-57.3" kJ·mol-1,回答下列问题。
H2O(l) ΔH="-57.3" kJ·mol-1,回答下列问题。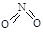 、
、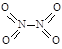 , NO2中氮氧键的键能为466 kJ·mol-1,N2O4中N-N键键能为167 kJ·mol-1,氮氧键的键能为438.5 kJ·mol-1,写出N2O4转化为NO2的热化学方程式 ;
, NO2中氮氧键的键能为466 kJ·mol-1,N2O4中N-N键键能为167 kJ·mol-1,氮氧键的键能为438.5 kJ·mol-1,写出N2O4转化为NO2的热化学方程式 ;  NiO(OH)+MH
NiO(OH)+MH
 Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1
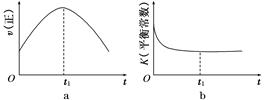
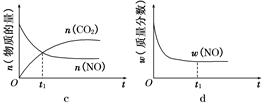
Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题: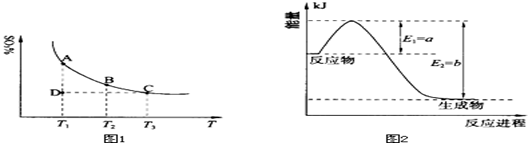
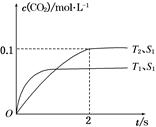
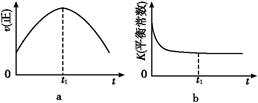
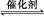 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
 N2(g)+CO2(g)+2H2O(g) ΔH1="-867" kJ/mol
N2(g)+CO2(g)+2H2O(g) ΔH1="-867" kJ/mol N2O4(g) ΔH2="-56.9" kJ/mol
N2O4(g) ΔH2="-56.9" kJ/mol
 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。