题目内容
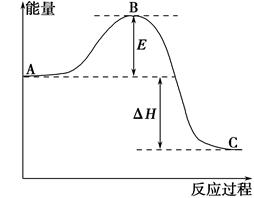
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察下图,然后回答问题。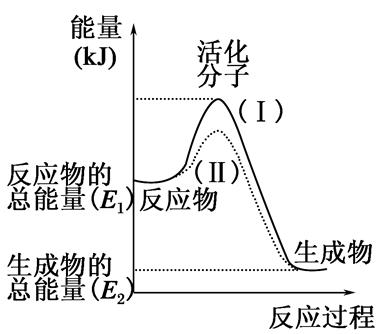
(1)图中所示反应是________(填“吸热”或“放热”)反应。
(2)已知拆开1mol H—H键、1mol I—I、1mol H—I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由1mol氢气和1mol 碘反应生成HI会________(填“放出”或“吸收”)________kJ的热量。在化学反应过程中,是将______转化为________。
(3)下列反应中,属于放热反应的是________,属于吸热反应的是________。
①物质燃烧
②炸药爆炸
③酸碱中和反应
④二氧化碳通过炽热的碳
⑤食物因氧化而腐败
⑥Ba(OH)2·8H2O与NH4Cl反应
⑦铁粉与稀盐酸反应
(1)放热 (2)放出 11 化学能 热能
(3)①②⑤⑦ ④⑥
解析

2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒。
汽车尾气净化的主要原理为:2NO(g)+2CO(g)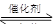 2CO2+N2。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断:
2CO2+N2。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断: 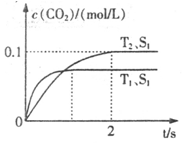
(1)该反应为 反应(填“放热”或“吸热”):在T2温度下,0~2s内的平均反应速率:v(N2)= ;(2)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在答题卡上画出 c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
(3)某科研机构,在t1℃下,体积恒定的密闭容器中,用气体传感器测得了不同时间的NO和CO的浓度(具体数据见下表,CO2和N2的起始浓度为0)。
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/xl0-4mol L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/xl0-3mol L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
t1℃时该反应的平衡常数K= ,平衡时NO的体积分数为 。
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。(下图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
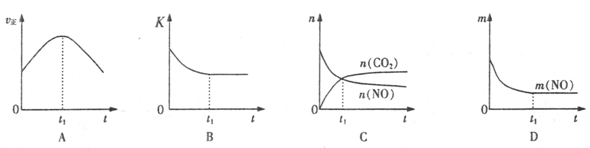
(5)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g) = N2 (g)+CO2 (g)+2H2O(g) △H=-867.0kJ ? mol-1
2NO2 (g)
 N2O4 (g) △H=-56.9kJ ? mol-1
N2O4 (g) △H=-56.9kJ ? mol-1H2O(g) = H2O(l) △H=-44.0kJ ? mol-1
写出CH4催化还原N2O4 (g)生成N2 (g)、CO2 (g)和H2O(l)的热化学方程式 。
(1)①根据下列图示,写出反应的热化学方程式____________________________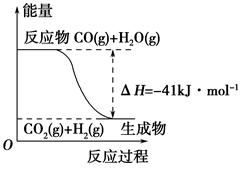
②根据如图所示情况,判断下列说法中正确的是______________。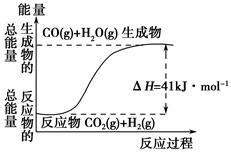
| A.其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=41 kJ·mol-1 |
| B.该反应为吸热反应 |
| C.该反应为放热反应 |
| D.当H2O为液态时,其反应热值小于41 kJ·mol-1 |
(3)如图是某温度下,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为___________________________
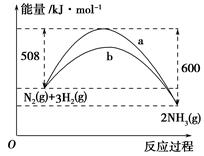
a、b两条曲线产生区别的原因很可能是
_________________________________________________________________。
 、
、 , NO2中氮氧键的键能为466 kJ·mol-1,N2O4中N-N键键能为167 kJ·mol-1,氮氧键的键能为438.5 kJ·mol-1,写出N2O4转化为NO2的热化学方程式 ;
, NO2中氮氧键的键能为466 kJ·mol-1,N2O4中N-N键键能为167 kJ·mol-1,氮氧键的键能为438.5 kJ·mol-1,写出N2O4转化为NO2的热化学方程式 ;  NiO(OH)+MH
NiO(OH)+MH 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,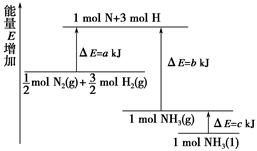
 mol N2(g)和
mol N2(g)和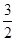 mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)________kJ能量。
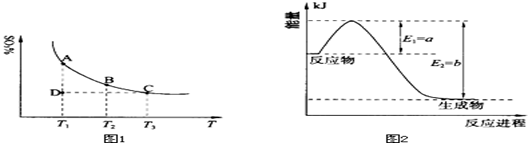
mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)________kJ能量。 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题: