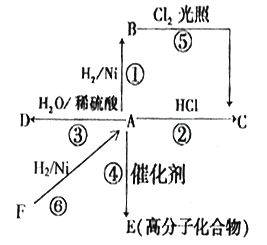
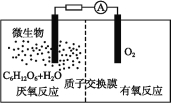
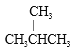
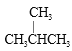
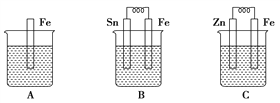
题目内容
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示。据图判断正确的是
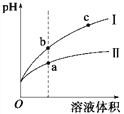
A. Ⅱ为盐酸稀释时的pH变化曲线
B. 溶液的导电性: a > b > c
C. a点KW的数值比c点KW的数值大
D. b点酸的总浓度大于a点酸的总浓度
【答案】B
【解析】A.II应为醋酸稀释时的pH值变化曲线,故A错误;B.溶液导电性取决于离子浓度,a点的H+浓度最大,c点最小,导电性 a > b > c,故B正确;C.KW的大小只取决于温度,两点相等,故C错误;D.相同pH值的盐酸和醋酸,醋酸浓度远大于盐酸的浓度,稀释到相同体积时,醋酸(II)浓度大于盐酸(I)浓度,酸的总浓度:b点<a点,故D错误;故选B。

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目