题目内容
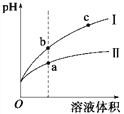
【题目】(1)合成氨工业中氢气可由天然气和水反应制备,其 主要反应为:CH4(g)+ 2H2O(g) ![]() CO2(g)+4H2(g),反应过程中 能量变化如图所示,则该反应为___________(填“吸热”或“放热”)。若已知,破坏 1mol 化学键需要吸收的热量如下表所示:
CO2(g)+4H2(g),反应过程中 能量变化如图所示,则该反应为___________(填“吸热”或“放热”)。若已知,破坏 1mol 化学键需要吸收的热量如下表所示:


则消耗 1molCH4 吸收或放出热量为___________________kJ(用含 a b c d 字母的代数式表示)。
(2)在某体积为2L的密闭容器中充入0.5molNO2和1molCO,在一定条件下发生反应:NO2+CO![]() CO2+NO,5min时,测得容器中NO的物质的量为0.2mol,则:
CO2+NO,5min时,测得容器中NO的物质的量为0.2mol,则:
①该段时间内,用 CO2 表示的平均反应速为_____________。
②假设此反应在 5 min 时达到平衡,则此时容器内气体的总物质的量为_________________。
③平衡时,NO2 的转化率为_________________。
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是_____________。
A.相同时间内消耗 n mol 的 NO2 的同时生成 n mol 的 CO2
B.NO2 的物质的量浓度不再改变
C.容器内气体的平均相对分子质量不变
D.v 正(NO)=v 逆(CO)
E.容器内压强不再发生变化
F.容器内气体的密度保持不变
G.温度和压强一定时,混合气体的颜色不再发生变化
【答案】 吸热 4a+4b-2c-4d 0.05mol/(L·min) 1.5mol 40% BDG
【解析】(1)反应过程中能量变化可知:反应物的能量低于生成物,反应为吸热反应;由方程式CH4+2H2O=CO2+4H2,可知消耗 1molCH4 吸收或放出热量为4a+4b-2c-4dkJ;( 2 ) ①NO2+CO ![]() CO2+NO,2 min 时,测得容器中 NO 的物质的量为 0.2 mol ,则CO2的物质的量为0.2mol,
CO2+NO,2 min 时,测得容器中 NO 的物质的量为 0.2 mol ,则CO2的物质的量为0.2mol,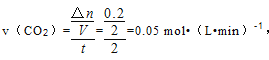 ②该反应前后体积不变,假设此反应在 5 min 时达到平衡,则此时容器内气体的总物质的量为 0.5mol+1mol=1.5mol;
②该反应前后体积不变,假设此反应在 5 min 时达到平衡,则此时容器内气体的总物质的量为 0.5mol+1mol=1.5mol;
③ NO2+CO ![]() CO2+NO,
CO2+NO,
n开始0.5mol 1mol 0 0
n变化0.2mol 0.2mol 0.2mol 0.2mol
n平衡0.3mol 0.8mol 0.2mol 0.2mol
平衡时,NO2 的转化率为0.2/0.5×100%=40%。
④达到化学平衡状态的是A.相同时间内消耗 n mol 的 NO2 的同时生成 n mol 的 CO2,均为正速率,故A错误;B.NO2 的物质的量浓度不再改变是平衡状态,故B正确;C.容器内气体的平均相对分子质量在数值上= m/n ,始终是一个不变量,所以容器内气体的平均相对分子质量不变时,不一定是平衡状态,故C错误;D.v 正(NO)=v 逆(CO),NO的消耗速率等效于NO的生成速率,与CO的消耗速率相等,反应达到平衡状态,故D正确;E.两边气体化学计量数相等,容器内压强始终不随时间的变化而变化,故E错误;F. 容器内的气体反应前后遵循质量守恒,容器内气体的质量保持不变,密度不变,不一定是平衡状态,故F错误;G. 温度和压强一定时,混合气体的颜色不再发生变化,NO2 的物质的量浓度不再改变是平衡状态,故G正确;故选BDG