题目内容
【题目】科学家开发出了多种太阳能电池,除晶体硅太阳能电池外,还有GaAs太阳能电池、铜铟镓硒薄膜太阳能电池等。
(1)基态Ga原子的电子排布式为___。
(2)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因___。
(3)与SeO3互为等电子体的两种阴离子___(写化学式)。
(4)AsF3是极性分子,理由是___。
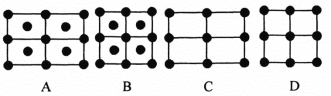
(5)金刚砂(SiC)晶胞如图所示:
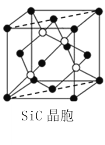
①金刚砂中硅原子的杂化轨道类型为___,沿晶胞图中虚线方向的切面图为___(填标号)。
②若晶胞参数为apm,阿伏加德罗常数为NA,则金刚砂的密度为___g·cm-3(列出表达式)。
【答案】[Ar]3d104s24p1 Cu2+的价电子排布为3d9,而Cu+为3d10的全充满稳定结构 CO32-、NO3- 分子中正、负电荷中心不重合 sp3 a ![]()
【解析】
(1)Ga为31号元素,基态Ga原子核外有31个电子,基态Ga原子的电子排布式为:1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1;
(2)Cu2+的价电子排布为3d9,而Cu+为3d10的全充满稳定结构,所以在高温下CuO能分解生成Cu2O;
(3)等电子体原子个数相同,价电子数相同,SeO3原子个数为4,价电子个数为24,与之互为等电子体的阴离子有CO32-、NO3-等;
(4)AsF3中新原子价层电子对数为3+![]() =4,含1对孤对电子,为三角锥形结构,分子中正负电荷重心不重合,属于极性分子;
=4,含1对孤对电子,为三角锥形结构,分子中正负电荷重心不重合,属于极性分子;
(5)①金刚砂中硅原子形成4个Si-C键,Si原子杂化轨道数目为4,Si原子采取sp3杂化。切面为长方形,面对角线上3个黑色球共线,面对角线为长方形的长,棱为长方形的宽,内部下方的2个白色球处于切面上,且到晶胞下底面虚线距离相等,图中(a)符合;
②晶胞中白色球数目为4、黑球数目为![]() ,故晶胞中Si、C原子数目均为4个,晶胞质量m=
,故晶胞中Si、C原子数目均为4个,晶胞质量m=![]() ,晶胞体积V=a3pm3=(a×10-10)cm3,所以晶胞的密度为
,晶胞体积V=a3pm3=(a×10-10)cm3,所以晶胞的密度为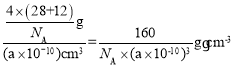 。
。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案【题目】软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:
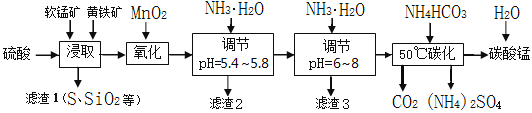
已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有_________。
A.适当升高温度 B.搅拌 C.加适量纯碱 D.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是____________________________________________。
(3)调节pH为5.4~5.8的目的是_____________________________________________。
(4)滤渣3的主要成分的化学式是_____________。
(5)50℃碳化过程发生反应的离子方程式是____________________________________。