题目内容
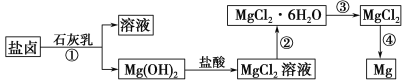
【题目】![]() 、CuCl是重要的化工原料,广泛地用作有机合成催化剂.实验室中以粗铜
、CuCl是重要的化工原料,广泛地用作有机合成催化剂.实验室中以粗铜![]() 含杂质
含杂质![]() 为原料,一种制备铜的氯化物的流程如下:
为原料,一种制备铜的氯化物的流程如下:

(1)上述流程中固体K溶于稀盐酸的目的是 ______ ![]() 试剂X、固体J的物质分别为 ______ .
试剂X、固体J的物质分别为 ______ .
A.NaOH![]() B.CuO
B.CuO![]() C.
C.![]()
![]()
![]()
![]()
(2)反应②是向溶液2中通入一定量的![]() ,加热一段时间后生成CuCl白色沉淀.写出制备CuCl的离子方程式 ______ .
,加热一段时间后生成CuCl白色沉淀.写出制备CuCl的离子方程式 ______ .
(3)以石墨为电极,电解![]() 溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式 ______ .
溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式 ______ .
【答案】防止![]() 水解 B
水解 B ![]()
![]()
【解析】
粗铜(含杂质Fe)与氯气反应生成氯化铁和氯化铜,加稀盐酸溶解,形成氯化铁和氯化铜溶液,再加试剂x为CuO或氢氧化铜等调节pH,使铁离子转化为氢氧化铁沉淀,过滤得到的固体J为氢氧化铁,溶液2为氯化铜溶液,通入二氧化硫,二氧化硫与铜离子发生氧化还原反应生成CuCl,氯化铜溶液在HCl氛围中蒸发结晶得到CuCl22H2O。
(1)流程中固体K溶于稀盐酸的目的是防止铜离子水解,试剂X、固体J的物质分别为氧化铜,氢氧化铁,选B,
故答案为:防止![]() 水解;冷却结晶,B;
水解;冷却结晶,B;
(2)根据信息可知:在加热条件下,![]() 与铜离子反应生成CuCl白色沉淀和
与铜离子反应生成CuCl白色沉淀和![]() ,其反应的离子方程式为:
,其反应的离子方程式为: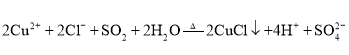 ;
;
故答案为: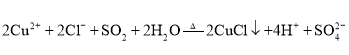 ;
;
(3)以石墨为电极,电解![]() 溶液时发现阴极上也会有部分CuCl析出,阴极上是得到电子发生还原反应,
溶液时发现阴极上也会有部分CuCl析出,阴极上是得到电子发生还原反应,![]() 得到电子生成CuCl,电极反应为:
得到电子生成CuCl,电极反应为:![]() ,
,
故答案为:![]() 。
。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】下列实验设计正确的是( )
操作 | 现象 | 结论 | |
A | 将SO2通入溴水 | 溴水褪色 | SO2具有漂白性 |
B | 将乙烯通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色 | 乙烯具有还原性 |
C | 将澄清石灰水滴入某溶液 | 出现白色浑浊 | 其溶液中存在CO32- |
D | 将硝酸银溶液滴入某溶液 | 出现白色沉淀 | 其溶液中存在Cl- |
A.AB.BC.CD.D