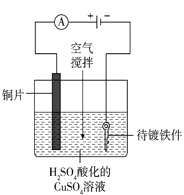
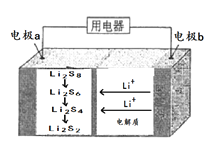
题目内容
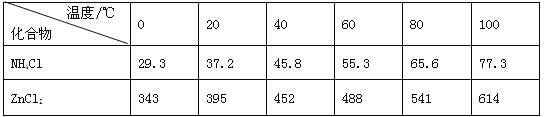
【题目】t ℃时,将一定量的混合气体在密闭容器中发生反应:aA(g)+bB(g) ![]() cC(g)+dD(g),平衡后测得B气体的浓度为0.6 mol·L-1。恒温下,将密闭容器的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4 mol·L-1。下列叙述中正确的是
cC(g)+dD(g),平衡后测得B气体的浓度为0.6 mol·L-1。恒温下,将密闭容器的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4 mol·L-1。下列叙述中正确的是
A. 重新达到平衡时,D的体积分数减小 B. a+b<c+d
C. 重新达到平衡时,A气体的浓度增大 D. 平衡向右移动
【答案】A
【解析】
保持温度不变,将密闭容器的容积扩大1倍1倍,如平衡不移动,B气体的浓度为0.3mol/L,实际B的浓度变为0.4mol/L,说明平衡向逆反应方向移动.
平衡向逆反应移动,D的体积分数减小,A正确;增大体积,压强减小,平衡向逆反应移动,压强减小平衡向气体物质的量增大的方向移动,即a+b>c+d,B错误;密闭容器的容积加倍,各物质的浓度都要减小,即A气体浓度减小,C错误;化学平衡逆向进行,向左移动,D错误。
故选A。

【题目】下列实验、现象、所对应的离子方程式不正确的是( )
选项 | 实验 | 现象 | 离子方程式 |
A | 将稀硫酸滴加到淀粉-KI溶液中 | 在空气中放置一段时间后溶液呈蓝色 | 4H++4I-+O2===2I2+2H2O |
B | 向FeBr2溶液中通入少量Cl2 | 溶液由浅绿色变棕黄色 | 2Fe2++Cl2===2Fe3++2Cl- |
C | 向氯水中加入适量NaOH溶液 | 溶液由黄绿色变为无色 | Cl2+2OH-===Cl-+ClO-+H2O |
D | 将Na2S加入到滴有酚酞的KCl溶液中 | 溶液由无色变为红色 | S2-+2H2O===H2S+2OH- |
A. AB. BC. CD. D
【题目】用分液漏斗向锥形瓶中滴加液体至过量,下列对锥形瓶中现象的预测符合实际情况的是
选项 | 锥形瓶 | 分液漏斗 | 预测现象 |
A | 酸性KMnO4溶液 | H2O2溶液 | 溶液紫红色逐渐褪去且产生大量气泡 |
B | Na2S溶液 | 久置氯水 | 生成淡黄色沉淀 |
C | Fe(OH)3胶体 | 盐酸 | 产生红褐色沉淀 |
D | Na2CO3溶液 | H2BO3溶液 | 产生大量气泡 |
A. AB. BC. CD. D